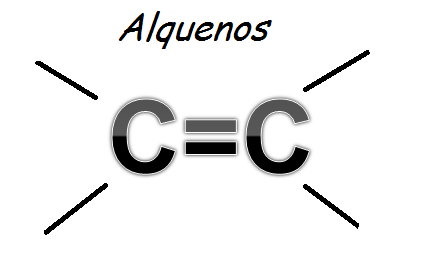
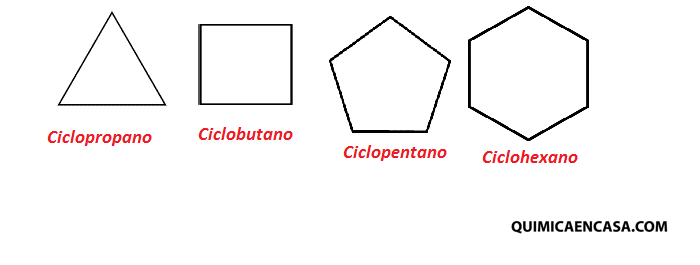
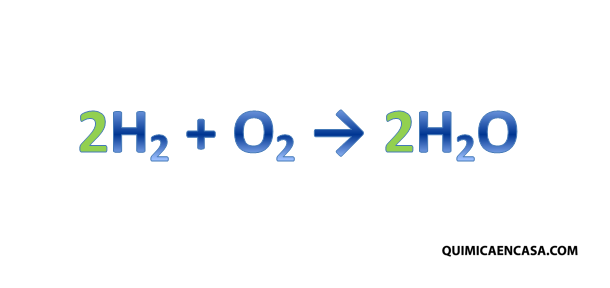Siempre cuando hablamos de ciencia pensamos en hombres como Albert Einstein, Stephen Hawking, Louis Pasteur, Nikola Tesla, entre otros, que han realizado grandes aportes a la humanidad. No obstante, es bastante probable que pocas personas conozcan los aportes tan significativos que han hecho las mujeres en cuanto a avances científicos, por tal razón hoy te resumiré las 5 científicas más influyentes de la historia.