El equilibrio químico es el estado de un sistema donde no se observan cambios en la concentración de los reactivos o productos, y que al transcurrir el tiempo, estas se mantienen constantes.

Este proceso se da en las reacciones reversibles, donde la velocidad de las reacción de reactivos a productos es la misma que de productos a reactivos.
Constante de equilibrio químico
La constante Kc para una reacción en equilibrio, es una fracción cuyo numerador es el producto de las concentraciones en mol/L de las sustancias del lado derecho y el denominador es el producto de las concentraciones en mol/L del lado izquierdo, cada concentración elevada a una potencia igual al coeficiente de la respectiva sustancia en la ecuación química balanceada.
La expresión matemática para Kc sería la siguiente:
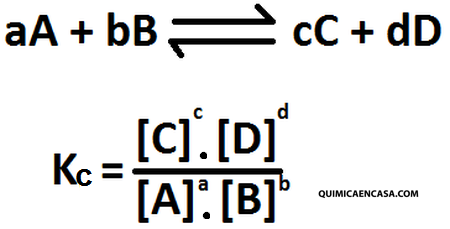
Todas las especies químicas deben estar en estado gaseoso para participar en el equilibrio. En el caso de que alguno de los productos o reactantes estén en estado sólido o líquido, no se les considera en la expresión de equilibrio (Kc) debido a la poca variación que sufren durante el proceso.
Por ejemplo, se tiene la siguiente reacción:
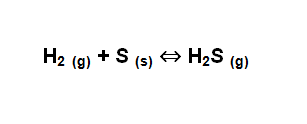
El primer paso es observar si necesita ser balanceada y luego descartar las especies que estén en estado sólido o en estado líquido.
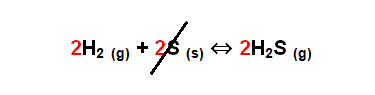
Para finalmente, escribir la expresión de la constante de equilibrio químico:
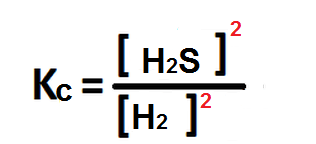
Ahora bien, se puede hallar el valor de Kc sabiendo que las especies involucradas presentan las siguientes concentraciones:
H2S = 5 mol/L
H2 = 1,5 mol/L
Sustituyendo en la constante anterior, nos queda:
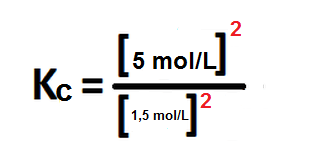
Kc= 11,11
- En un recipiente de 1 litro de capacidad se encuentran mezclados 10 moles de CO y 5 moles de H2O, sabiendo que la Kc es 8,25. Calcule la concentración en equilibrio de todas las especies involucradas en la reacción.
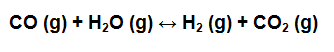
Primero se balancea la reacción si es necesario y luego se escribe la expresión de Kc para la reacción:
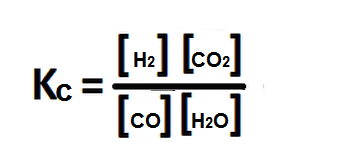
Luego se hallan las concentraciones en el equilibrio.
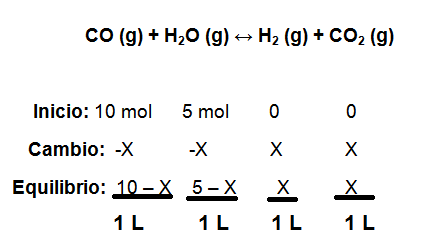
Ahora sustituimos los valores de las concentraciones en equilibrio en la constante de equilibrio anterior:
Se descarta el valor del volumen ya que para efecto de los cálculos matemáticos, es despreciable.

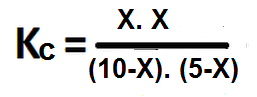
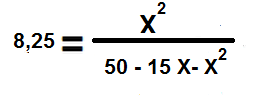
8,25. (50-15X +X2 ) = X2
412,5 – 123,75 X + 8,25 X2 – X2 = 0
412, 5 – 123,75 X + 7,25 X2 = 0
Se aplica la ecuación de segundo grado:
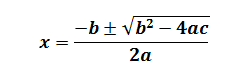
y queda que X1 = 12,53 y X2= 4,54. El valor que tomaremos para hallar las concentraciones en equilibrio es el de X2 ya que el valor de X1 es muy alto con respecto a las concentraciones iniciales.
Finalmente se hallan las concentraciones en el equilibrio:
H2 = CO2 = X = 4,54 mol ÷ 1 Litro = 4,54 mol/L
CO = 10 – X = 10- 4,54 ÷ 1 Litro = 5,46 mol/L
H2O = 5- X = 5- 4,54 ÷ 1 Litro = 0,46 mol/L

