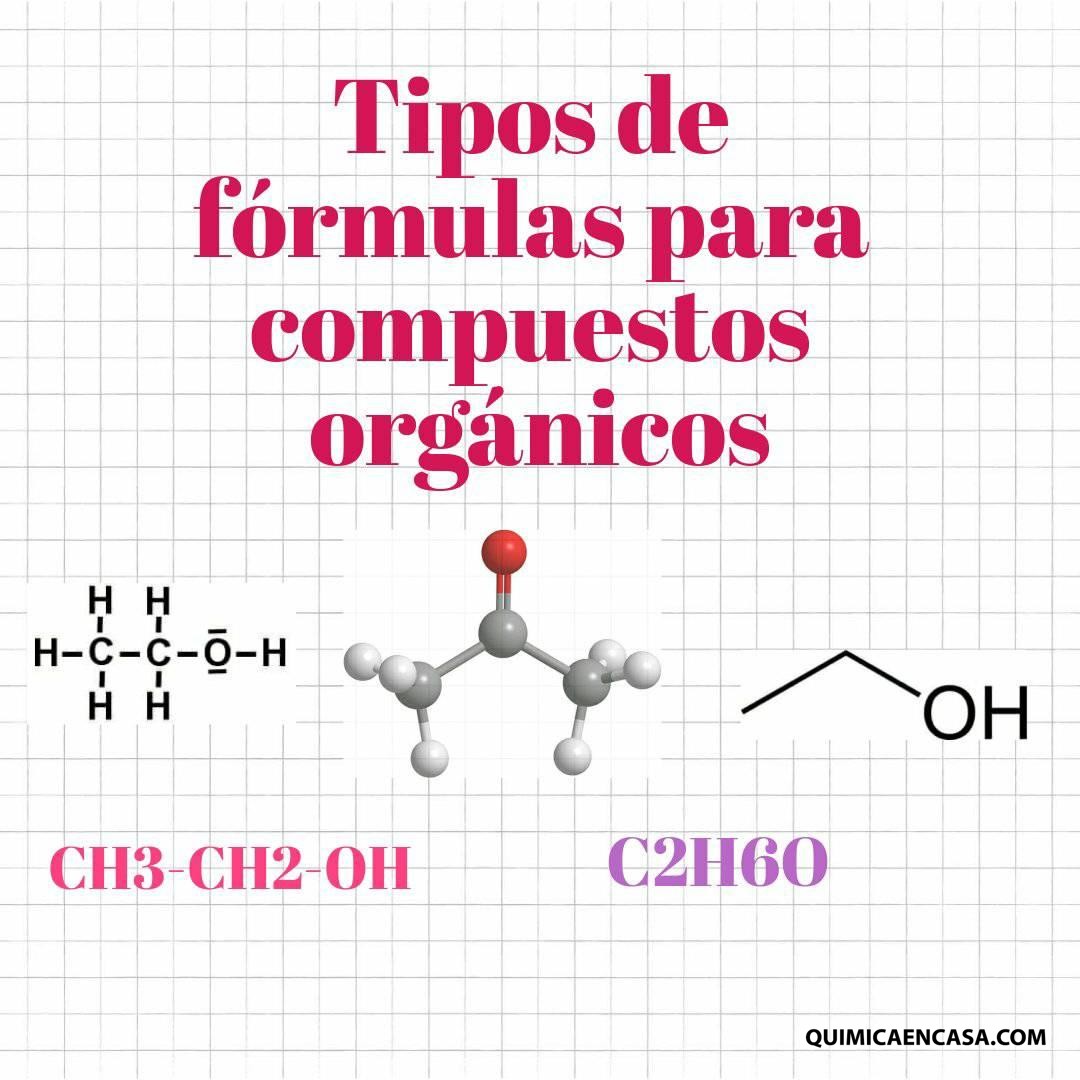
Los números cuánticos determinan la región del espacio-energía de mayor probabilidad de encontrar a un electrón.

Por lo tanto, los números son valores numéricos que indican las características que poseen los electrones de los átomos. Ningún electrón de un mismo átomo puede tener los mismos números cuánticos.Leer más…«Números cuánticos»