El cambio energético que se produce en toda reacción química se expresa en la mayoría de los casos en forma de calor, pero en algunas ocasiones se manifiesta en forma de energía eléctrica. A continuación exploraremos estas manifestaciones y su relación con el cambio químico.
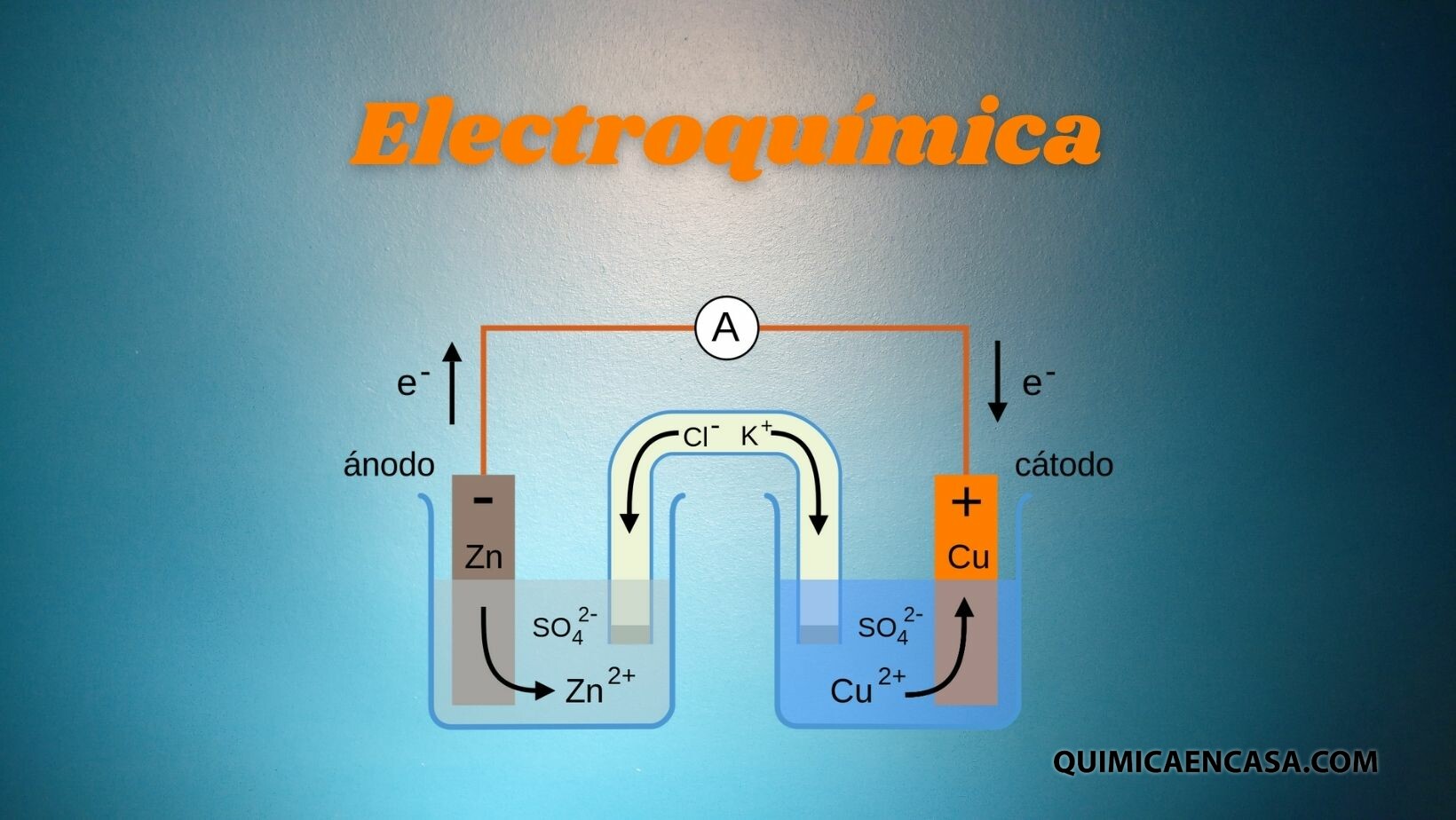
La electroquímica es la parte de la química que se encarga del estudio de la conversión de energía eléctrica en energía química y también de los factores que la afectan.Leer más…«Electroquímica»