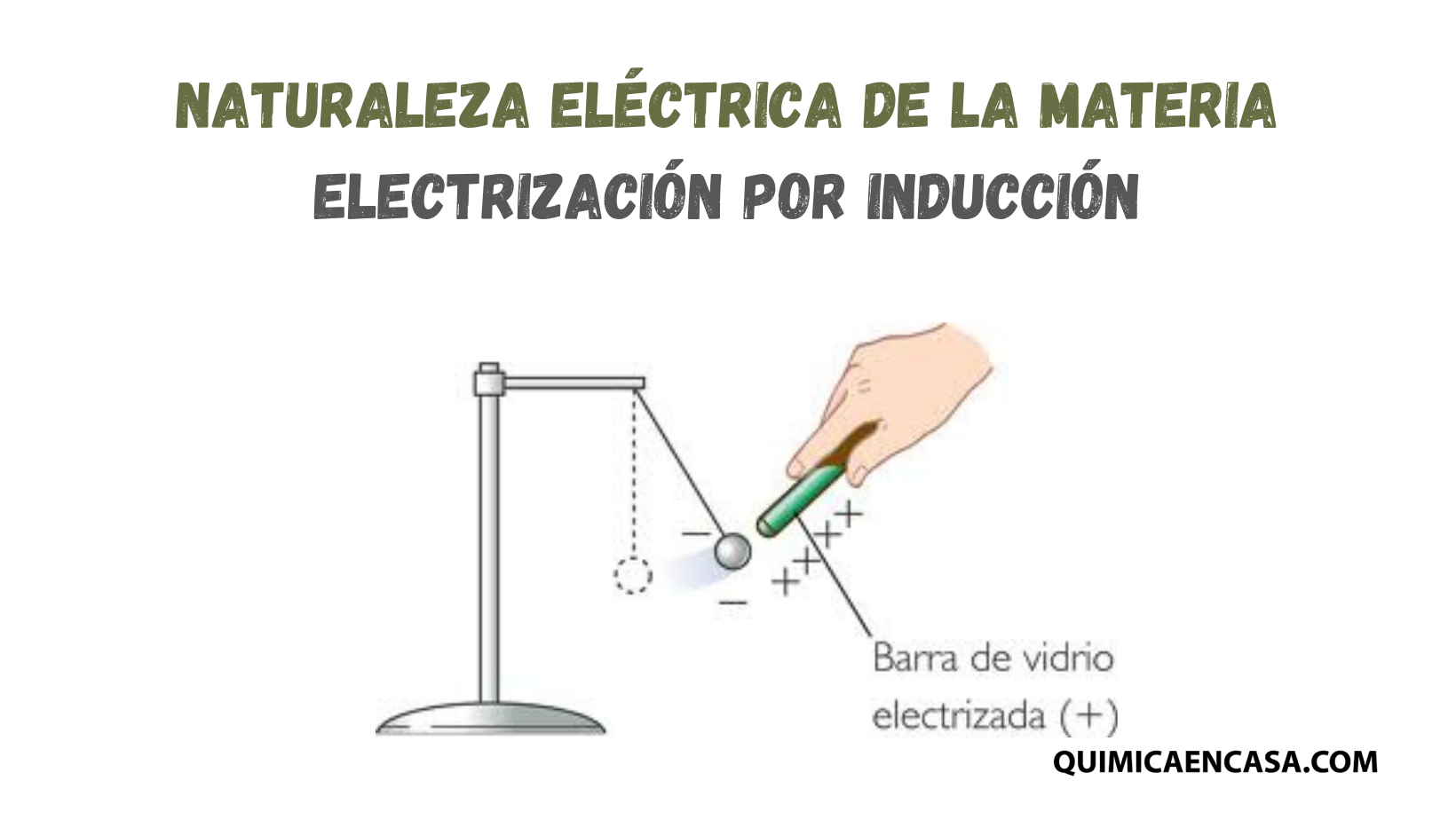
Los protones son aquellas partículas subatómicas de carga positiva, perteneciente a la familia de los fermiones, y se hallan en la parte interna del núcleo atómico. El protón tiene una carga igual y opuesta a la carga de un electrón. En consecuencia, en un átomo neutro, la cantidad de electrones es igual al número de protones.
Los protones son bastante pequeños, aproximadamente de 0,0001 Angstroms (Å). Para que tengan una idea, un átomo mide 1 angstrom (Å), entonces los protones son increíblemente más pequeños que los átomos. No obstante, estos presentan una fuerza impresionante ya que se empujan entre sí ejerciendo una fuerza de 100 Newtons.
¿Quién descubrió el protón?
El descubrimiento del protón se le atribuye al científico británico Ernest Rutherford. Dicho hallazgo se llevó a cabo en el año 1918, cuando Rutherford, durante la realización de experimentos con gas nitrógeno, observó que al proyectar partículas alfa contra el gas, sus instrumentos revelaban la existencia de núcleos de hidrógeno.Leer más…«El Protón: descubrimiento y características»