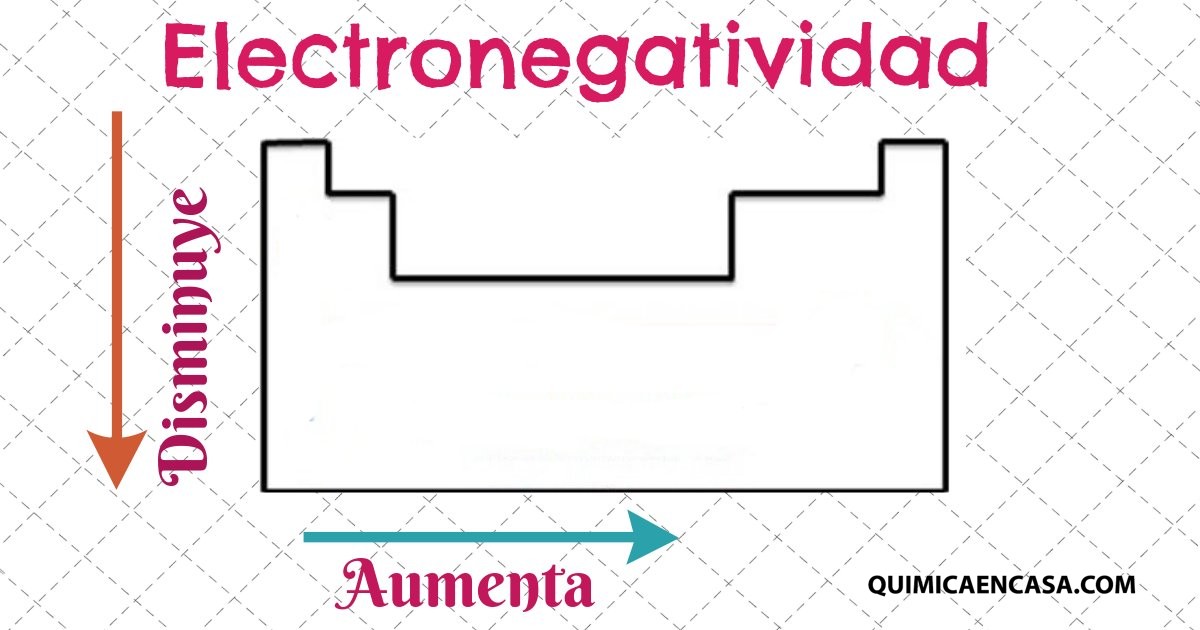
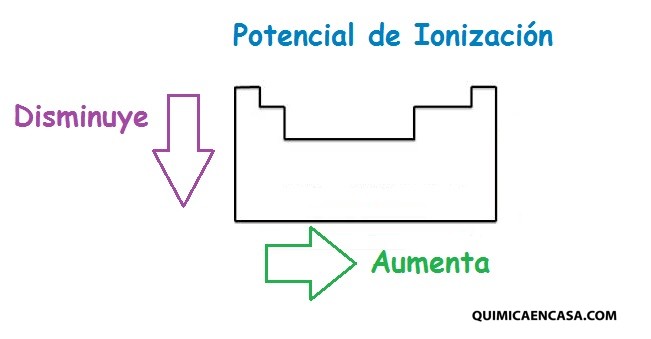
La representación de la tabla periódica está profundamente relacionada con la configuración electrónica de los átomos de los elementos químicos. Por ejemplo, todos los elementos del grupo 1 tienen una configuración electrónica [E] ns1 (donde [E] es la configuración del gas inerte correspondiente), y tienen una gran similitud en sus propiedades químicas.

La capa electrónica más externa se llama «capa de valencia» y establece las propiedades químicas. Es importante recordar que el hecho de que las propiedades químicas sean parecidas para los elementos de un grupo fue descubierto hace más de un siglo, mucho antes inclusive de surgir la idea de configuración electrónica. La regla de Madelung, no está muy clara de cómo se muestra en la tabla periódica, ya que algunas propiedades (tales como el estado de oxidación +2 en la primera fila de los metales de transición) serían diferentes con un orden de llenado de orbitales distinto.Leer más…«Distribución electrónica en la tabla periódica»