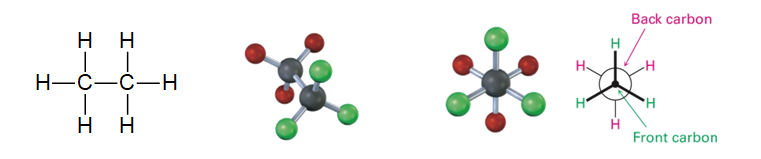
En química orgánica, no basta con saber qué átomos están conectados; la orientación espacial de esos átomos (su conformación) es crucial. Las moléculas no son estáticas; giran constantemente alrededor de sus enlaces simples. Para entender esta «danza», los químicos usan las Proyecciones de Newman.
¿Qué son las Proyecciones de Newman?
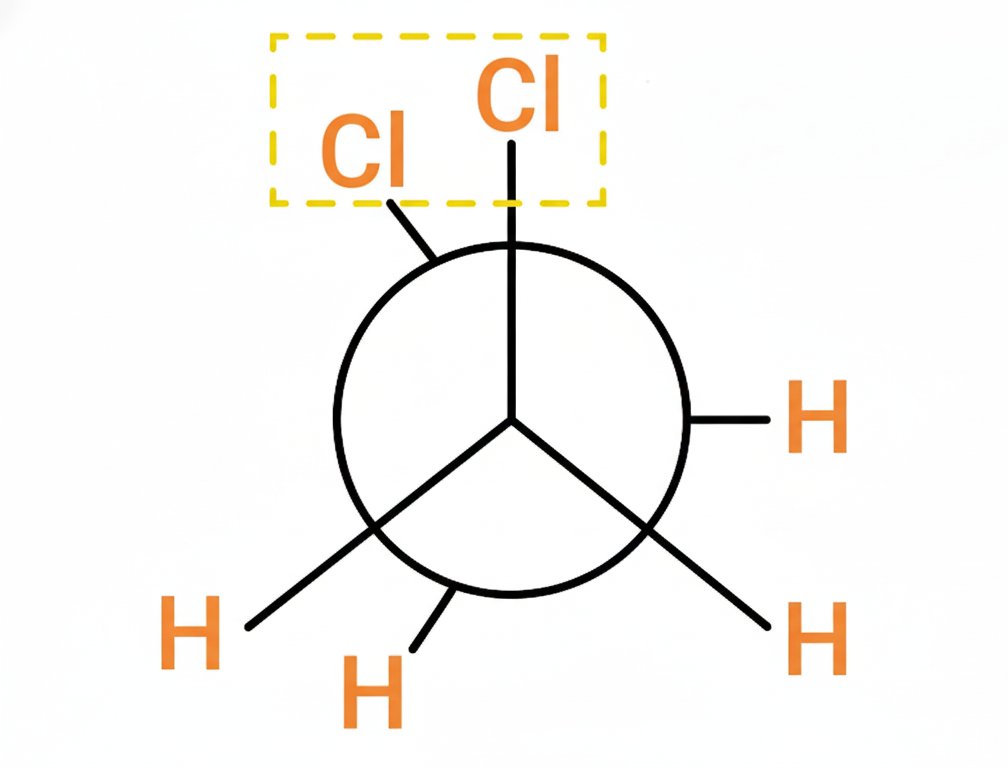
Son una forma de representar las conformaciones de una molécula observando a lo largo de un enlace carbono-carbono específico. Nos permiten visualizar los grupos unidos a esos dos carbonos y cómo interactúan entre sí.
- La Visión: Imagina que miras directamente por encima de un enlace C-C.
- El carbono frontal se representa como un punto en el centro.
- El carbono trasero se representa como un círculo grande que rodea el carbono frontal.
- Los grupos unidos a cada carbono se dibujan saliendo de ese punto o círculo.