Los hidrocarburos saturados de cadena cerrada se le llaman cicloalcanos y pertenecen al grupo de los compuestos alicíclicos. Su fórmula general es CnH2n, la cual poseen dos átomos menos de hidrógeno que el alcano del cual derivan.

Los hidrocarburos saturados de cadena cerrada se le llaman cicloalcanos y pertenecen al grupo de los compuestos alicíclicos. Su fórmula general es CnH2n, la cual poseen dos átomos menos de hidrógeno que el alcano del cual derivan.
Los alcanos se pueden nombrar utilizando la nomenclatura IUPAC o por la nomenclatura Común.
El nombre del alcano lineal consta de dos partes:
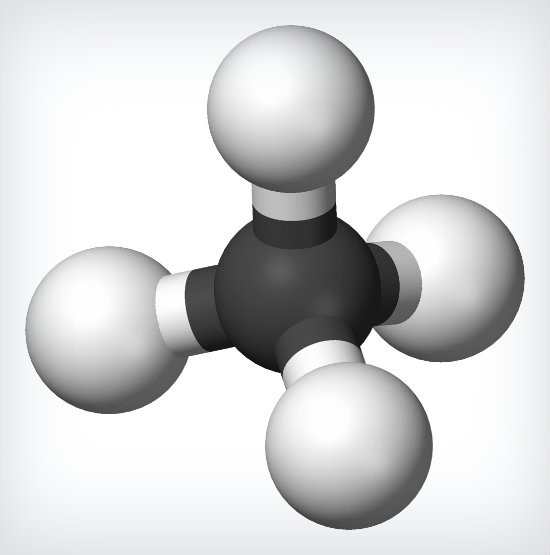
Los alcanos son llamados también parafinas y son hidrocarburos alifáticos (cadenas abiertas de carbono) que tienen el máximo número de átomos de hidrógeno posible según la configuración electrónica que presenta el átomo de carbono.


La constante de la gravitación que se exhibe en la teoría newtoniana de la gravitación puede determinarse calculando la fuerza de atracción entre dos cuerpos, de un kilogramo (kg) cada uno, separados a un metro de distancia. Newton enunció la siguiente ley, conocida como ley de gravitación universal:

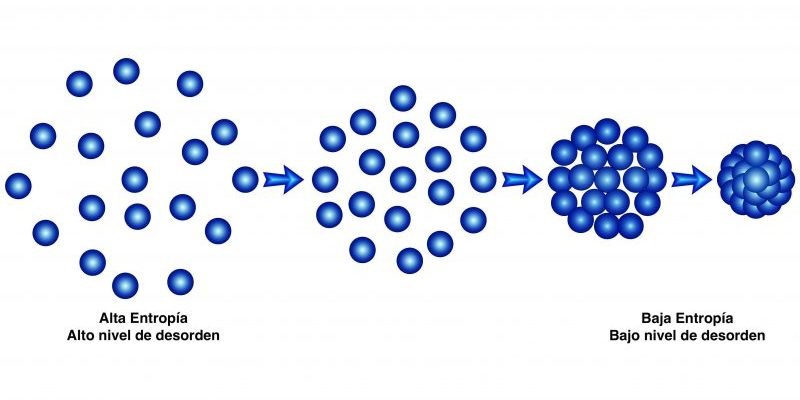
La palabra entropía procede del griego y significa evolución o transformación. En termodinámica se le conoce como la medida del grado de desorden de las partículas que constituyen una sustancia en un sistema.
Un enlace químico es el acercamiento de dos átomos interactuando químicamente para producir una molécula.

Por su parte, la entalpía de enlace se define como la cantidad de energía que hay que suministrar a un par de átomos para romper la interacción química presente entre ellos. Su valor es característico para cada tipo de reacción.
La entalpía es el contenido calórico de una especie química. Se simboliza con la letra H mayúscula.
La variación de entalpía, por su parte, se conoce como la ganancia o pérdida de energía calórica que tiene lugar en un proceso y además se relaciona de manera directa con el contenido energético que presentan las especies químicas, antes y después del cambio.

Investigadores lo han revelado en base al estudio de átomos de potasio y utilizando inteligencia artificial. Si se pudiera extraer una porción de este material, se vería como un bloque sólido que pierde potasio fundido y que finalmente se disuelve.Leer más…«Científicos descubrieron este nuevo estado de la materia usando inteligencia artificial.»
