
Enlace Iónico
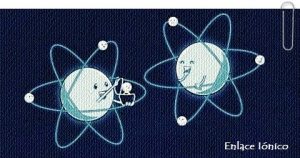
Es la fuerza que permite la unión de dos átomos a través de una transferencia electrónica. Dicha transferencia se lleva a cabo cuando un elemento electropositivo se une con un elemento electronegativo. El enlace iónico será más fuerte a medida de que la diferencia de electronegatividad entre los elementos sea mayor. Se considera que es un enlace iónico, cuando la diferencia de electronegatividad entre los elementos involucrados es mayor a 1.7.Leer más…«Enlace Iónico»
Usar acondicionador para el cabello puede ser peligroso en caso de un ataque nuclear
En estos últimos meses se ha creado una especie de paranoia acerca de posibles ataques nucleares, y no es por nada (sin ánimos de adentrarme en lo político) es algo creíble, luego de la creciente tensión entre Corea del Norte y Estados Unidos.
Entonces, si llegara a suceder un conflicto nuclear cerca de donde vives, es vital saber qué hacer y qué no hacer.
 Leer más…«Usar acondicionador para el cabello puede ser peligroso en caso de un ataque nuclear»
Leer más…«Usar acondicionador para el cabello puede ser peligroso en caso de un ataque nuclear»
Agua superenfriada

Agua superenfriada se congela en contacto con el hielo
¿Por qué ocurre esto? ¿Qué es el proceso de superenfriamiento?
La ciencia te explica por qué mojar las galletas en leche es tan delicioso

Todos amamos las galletas, desde los niños hasta los más adultos y ¿cómo no? Si son tan deliciosas. Mis preferidas son las de chispas de chocolate, a otros les gusta de vainilla, avena, mantequilla y muchos otros sabores. Pero lo que lo hace aún más delicioso es el hecho de poder mojarlas en una buena taza de leche.
De hecho, según algunos científicos, comer galletas con leche está diseñado para tener un buen sabor.
Leer más…«La ciencia te explica por qué mojar las galletas en leche es tan delicioso»
¿Sabías que las bananas son radiactivas?
Las bananas son radiactivas, pero dicha energía que expulsan no es peligrosa. Esto ocurre porque la banana es rica en potasio, elemento químico que tiene numerosos isótopos como el potasio-40 (40K), el cual es una fuente de radiactividad de intensidad baja.
Acabemos con el mito de la “planta de acetaminofén”
La medicina alternativa siempre ha estado presente desde el inicio de las civilizaciones. Aprovechar las propiedades de ciertas plantas y frutos para el beneficio de nuestra salud, es algo a lo que siempre deberíamos apostar, pero ¿qué sucede cuando una mentira se hace eco y puede llegar a afectarnos? Bueno es lo que sucede con la supuesta “planta de acetaminofén”.
 Leer más…«Acabemos con el mito de la “planta de acetaminofén”»
Leer más…«Acabemos con el mito de la “planta de acetaminofén”»
¡Una reacción muy peligrosa!

El sodio elemental reacciona fácilmente con el agua de acuerdo con el siguiente mecanismo de reacción:
2Na(s) + 2H2O –> 2NaOH(aq) + H2(g)
¿Sabías que no es bueno beber café en las primeras horas de la mañana?
Quizás esto te sorprenda un poco, pero no es bueno beber café en las primeras hora de la mañana. Esto es debido al alto nivel de cortisol que existe en nuestro organismo temprano por la mañana, así que tomar café no es lo más indicado.
 Leer más…«¿Sabías que no es bueno beber café en las primeras horas de la mañana?»
Leer más…«¿Sabías que no es bueno beber café en las primeras horas de la mañana?»
Propiedades Características: Densidad
Las propiedades características o intensivas son aquellas que no dependen de la cantidad de materia que esta contenga, sino de las propiedades que estas presenten. Son las propiedades ideales para identificar y clasificar sustancias puras ya que son independientes del tamaño, forma o volumen que presente dicho material.
Por ejemplo, si tenemos dos recipientes que contienen volúmenes iguales de líquidos, que a simple vista lucen igual ¿cómo lo identificas? Evidentemente no podríamos utilizar las propiedades no características como la masa, volumen y temperatura y tendríamos que recurrir a las propiedades características como la densidad, punto de ebullición, punto de fusión y solubilidad ya que estas nos dirán con precisión las propiedades que presenta cada líquido y por consiguiente será posible su identificación.
Para efectos de este post, hablaremos sobre la densidad.Leer más…«Propiedades Características: Densidad»


