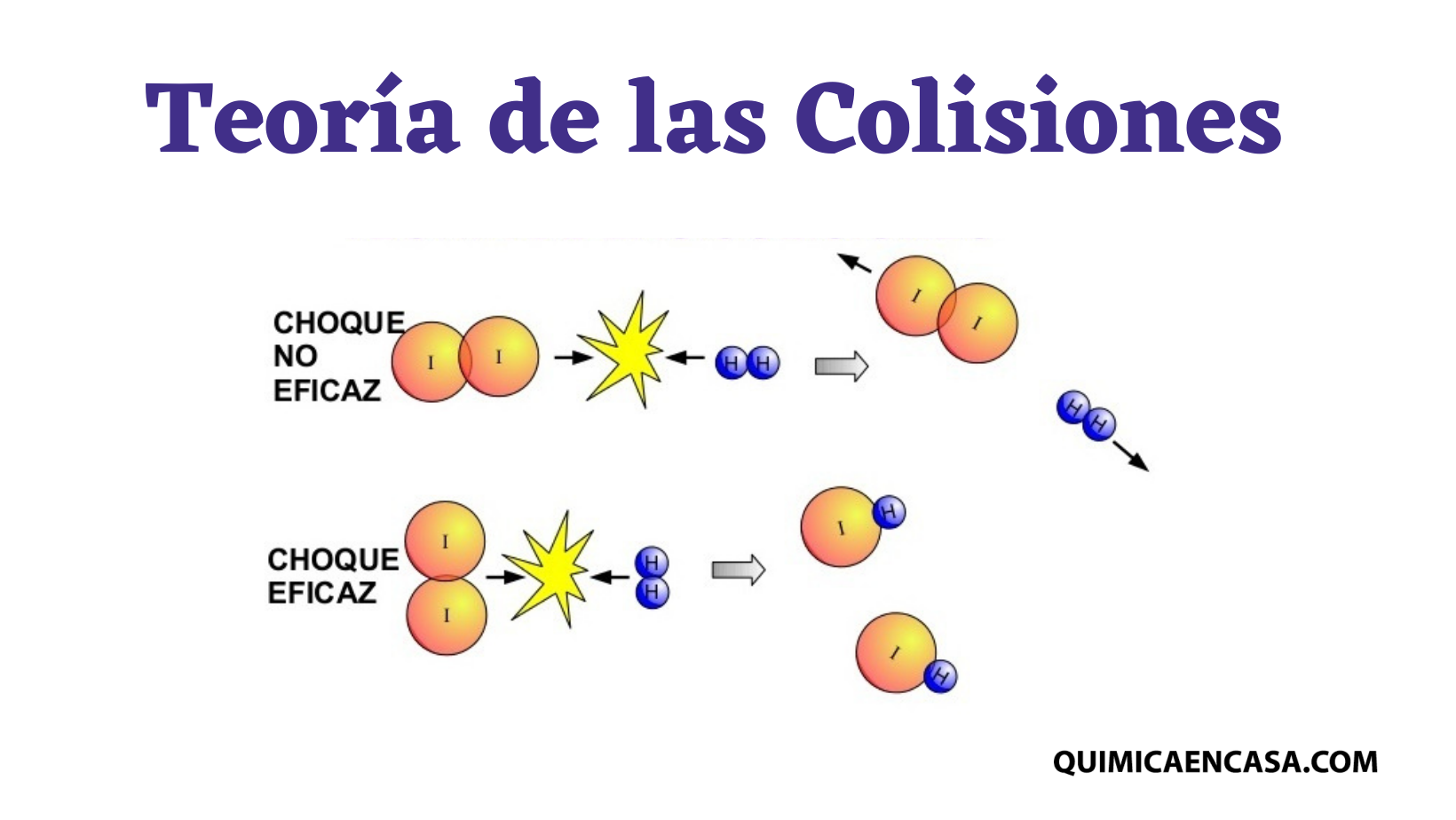
Los estereoisómeros son isómeros de moléculas que poseen enlaces átomo-átomo iguales que la molécula, con la diferencia de que cambia la disposición espacial. Estos se pueden dividir en isómeros conformacionales y en isómeros configuracionales.
Para efectos de este artículo, hablaremos de los isómeros configuracionales. Hay diferentes clases de isómeros configuracionales, como son los enantiómeros y los diasteroisómeros.
Compuestos Meso
Son aquellos que presentan carbonos asimétricos y son superponibles a su imagen, por lo tanto, son ópticamente inactivos, eso quiere decir que su imagen especular es el mismo compuesto. Este tipo de compuestos son aquirales (existe un plano de simetría).
Veamos el siguiente ejemplo donde a través de la proyección de Fisher, queda representando el compuesto 2,11-dimetil-6,7-diamino-dodecano, como un compuesto meso.Leer más…«Diferencias entre los compuestos meso, enantiómeros y diastereoisómeros»