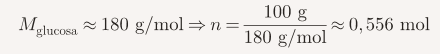La molaridad es una de las formas más usadas para expresar concentración en química. Se define como la cantidad de mol de soluto disueltos en un litro de solución. En este ejercicio aprenderás a calcular la molaridad de una solución de hidróxido de sodio (NaOH) preparada en el laboratorio, siguiendo un método claro y sencillo.
Enunciado del ejercicio
¿Cuál es la molaridad de una solución preparada con 10 g de NaOH disueltos en 250 mL de agua?
Paso a paso para resolver
- Identificar los datos del problema
- Masa de NaOH: 10 g
- Volumen de solución: 250 mL = 0,250 L
- Masa molar del NaOH: 40 g/mol
Leer más…«Ejercicio de molaridad: cómo calcular la concentración de una solución»