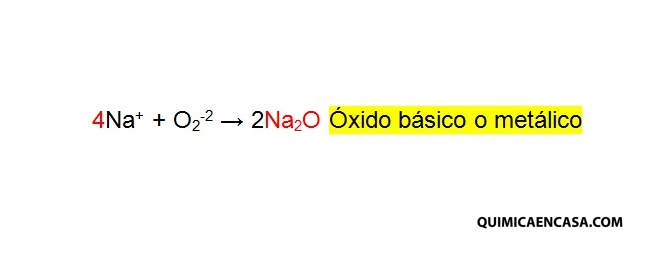Los óxidos son compuestos inorgánicos formados por la combinación del oxígeno con algún otro elemento. Estos pueden presentarse en los tres estados de la materia: sólido, líquido y gaseoso. Son compuestos que se hallan de forma abundante en la corteza terrestre, como por ejemplo: el monóxido de nitrógeno, dióxido de nitrógeno, dióxido de carbono, entre otros.
Clasificación de los óxidos
Según su comportamiento químico:
Óxido básico. También llamados óxidos metálicos, son aquellos que surgen de la combinación de un metal con el oxígeno. Por ejemplo: Na2O
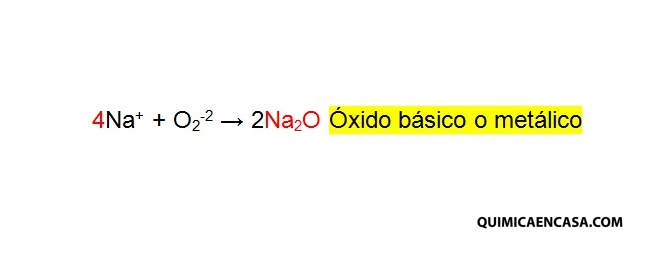
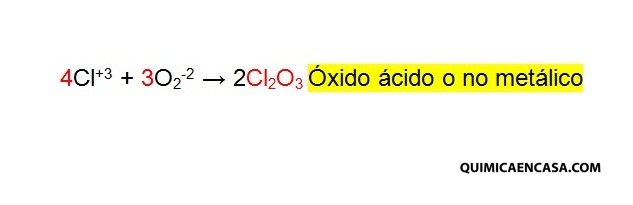
Óxido ácido. También llamados óxidos no metálicos, son aquellos que surgen de la combinación de un no metal con el oxígeno. Por ejemplo: Cl2O3
Óxido anfótero. Son aquellos óxidos formados por la combinación de un elemento anfótero y el oxígeno. Los elementos anfóteros son aquellos que actúan como ácidos y como bases. Algunos metales y metaloides poseen esta característica formando óxidos anfóteros como por ejemplo: zinc, plomo, aluminio, berilio y estaño. Por ejemplo: Al2O3Leer más…«Óxidos: Clasificación y usos»