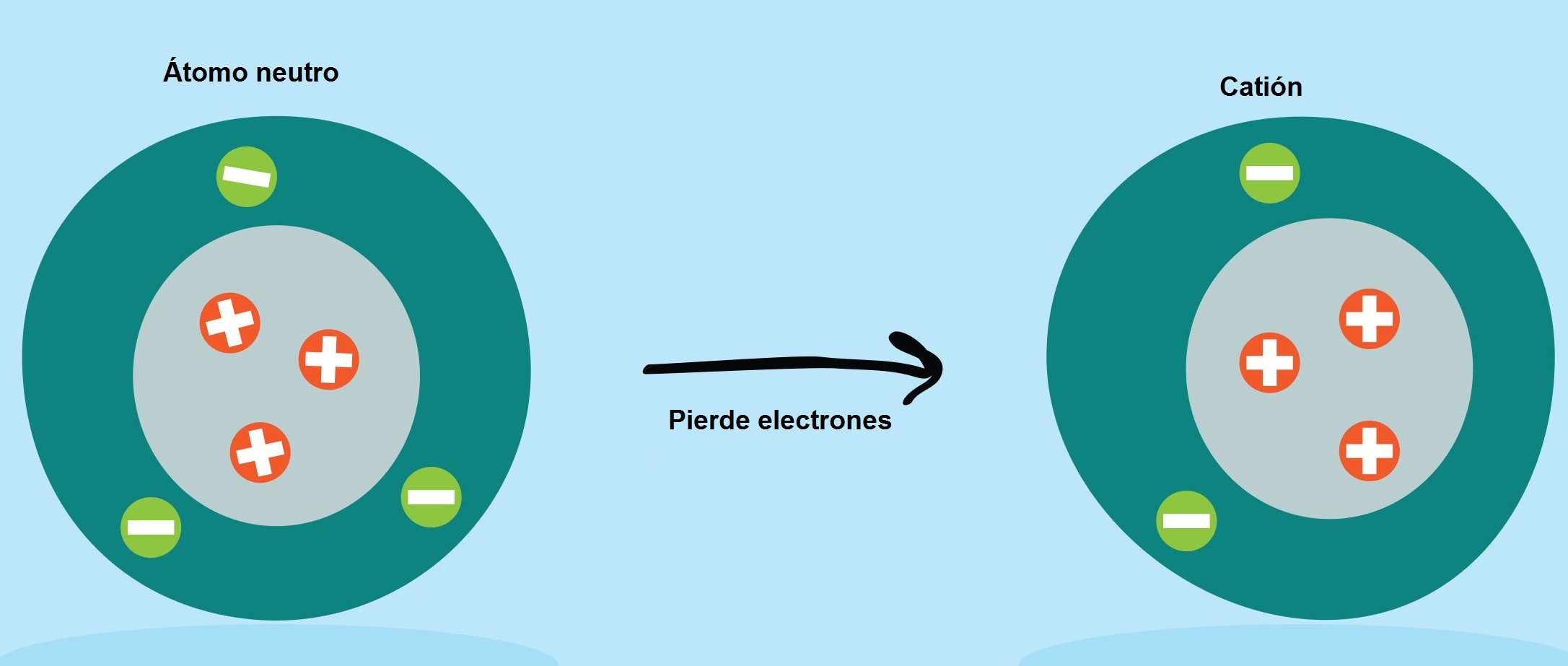
Los iones son átomos que adquieren carga positiva o carga negativa, producto de una transferencia de electrones. Cuando el átomo neutro cede (pierde) electrones se le llama catión y cuando el átomo neutro acepta (gana) electrones se le llama anión.
Los cationes son de carga positiva, ya que posee mayor cantidad de protones en su núcleo que electrones.