¡La tabla periódica siempre lo supo y no nos dimos cuenta! ¡qué año tan Ca² !


¡La tabla periódica siempre lo supo y no nos dimos cuenta! ¡qué año tan Ca² !

Cuando se realiza un análisis y estudio a las características que poseen los elementos, se puede hacer bastante evidente las diferentes propiedades que estas presentan. Uno de los aspectos más notables es la manera en la cual se combinan con otros elementos. Muchos de ellos poseen una gran capacidad de combinación con otros elementos, no obstante existen otros que son más selectivos en ese aspecto y algunos que no tienen la propiedad de formar uniones naturales con otros elementos, tal es el caso de los gases nobles.

Los gases nobles se le hace llamar a los elementos que se encuentran formando parte del grupo 18 de la tabla periódica. Estos elementos poseen una estructura atómica bastante curiosa, ya que las últimas capas de electrones presentan orbitales llenos lo que hace casi imposible la formación de compuestos, ya sea forzando las condiciones de temperatura y presión. Sin embargo, el primer compuesto producido a partir de un gas noble es el hexafluoroplatinato de xenón. El químico británico Neil Bartlett fue quien descubrió dicho compuesto en el año 1962; el cual formuló como Xe+ (PtF6)–.Leer más…«Propiedades Periódicas: Capacidad de combinación / Valencia»
Esta propiedad nos permite conocer la capacidad que posee un átomo para atraer electrones hacia él cuando se haya formando parte de un enlace covalente. La electronegatividad predice la polaridad de los enlaces, de manera que es posible saber si se está en presencia de un enlace iónico o covalente.
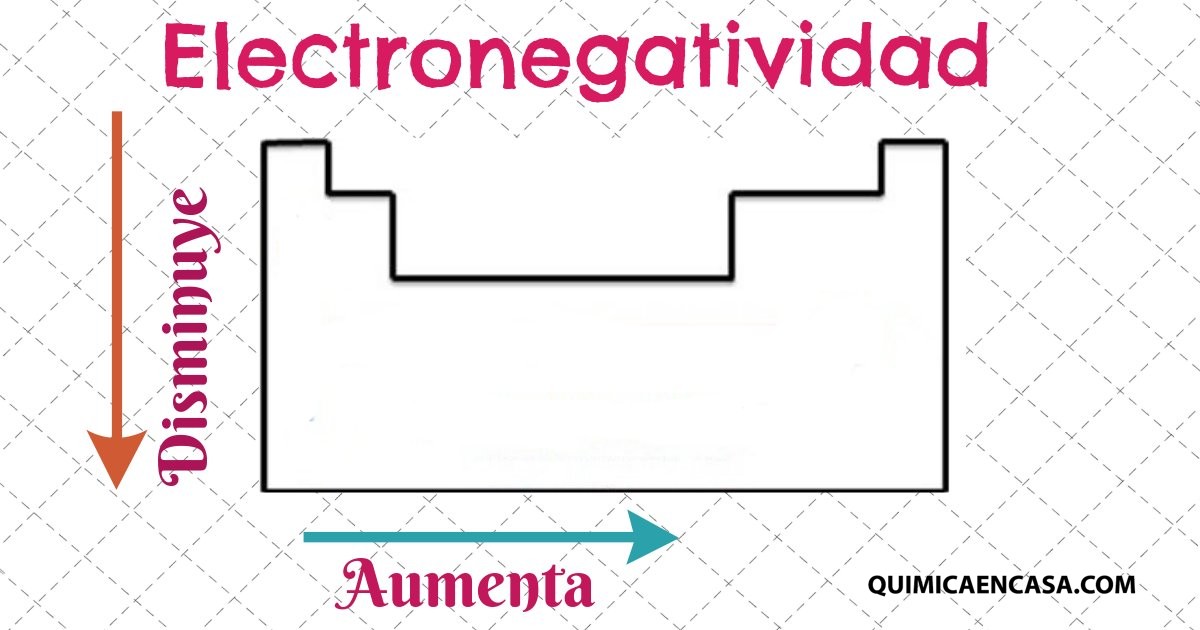
Para el año 1932, el científico estadounidense, Linus Carl Pauling, concibió la idea de la electronegatividad de los elementos y definió dicha propiedad como la medida de la tendencia de un átomo para atraer electrones.
Para llegar a dicha conclusión, empleó numerosas características que presentan las moléculas, principalmente el momento dipolar y la energía requerida para fragmentar los enlaces.Leer más…«Propiedades Periódicas: Electronegatividad»
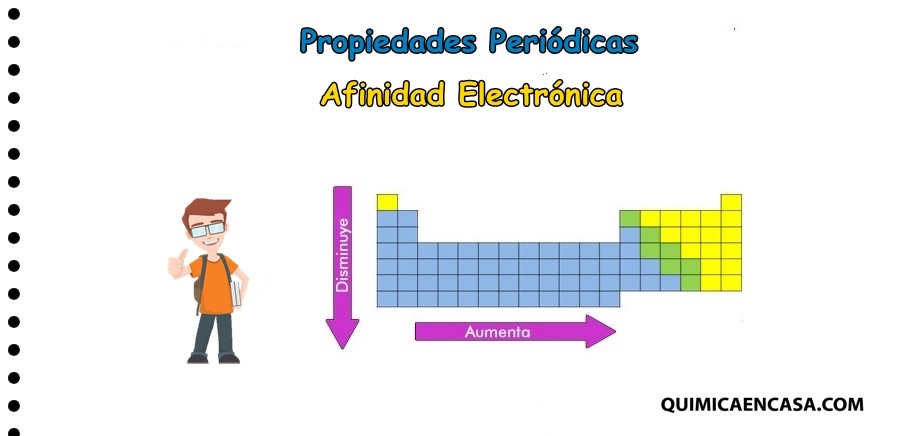
La afinidad electrónica es la medida de la variación energética que se produce al introducir un electrón en la última capa de un átomo. También se le define como la energía que libera un átomo gaseoso cuando se encuentra en su estado fundamental y capta un electrón libre, transformándose así en un ion mononegativo.
La afinidad electrónica aumenta en la medida que la capa en la cual se introduce es más pequeña o de menor contenido energético.
El potencial de ionización es la energía necesaria para arrancar un electrón de un elemento químico, hallándose en su estado fundamental de energía. A medida que el electrón se encuentre fuertemente unido al núcleo, el potencial de ionización será mayor. En relación con eso, una de las primeras relaciones que se pueden hacer es con respecto al radio atómico. Entonces, cuando el átomo presenta mayor radio atómico, menor será la fuerza que los une; y por consiguiente, menor será el potencial de ionización.
Dmitri Mendeléyev, químico ruso creador de la tabla periódica descubrió que, una vez ordenados los elementos químicos de manera creciente en relación a sus números atómicos, ocurre una repetición de las propiedades físicas y químicas, en intervalos iguales. Entonces los elementos cuyos átomos presentan estructuras electrónicas iguales en sus capas externas, poseen diversas propiedades químicas en común.
Por lo tanto, se puede definir a las propiedades periódicas como la coincidencia de los átomos en la estructura electrónica, que a pesar de tener diferentes números atómicos, exhiben propiedades similares. Algunas de las propiedades periódicas más resaltantes están: la capacidad de combinación (valencia), radio atómico, potencial de ionización, afinidad electrónica y electronegatividad. Para efecto de este artículo, se hará referencia al radio atómico.

Se entienden por fórmula molecular de una sustancia, aquella fórmula que revela el número exacto de átomos de cada uno de los elementos que la constituyen. Como es necesario conocer la masa molecular de la sustancia, las fórmulas moleculares solo se asignan con precisión a las sustancias gaseosas y líquidas.
Las fórmulas empíricas de una sustancia, son aquellas que muestran la relación más sencilla entre sus elementos constituyentes.
El 30 de diciembre de 2015, la IUPAC anunció en su portal web la verificación del descubrimiento de cuatro elementos del periodo 7, entre ellos el oganesón.

Los estados de oxidación son los números que se le asignan al átomo de un elemento o de compuestos para poder determinar el desplazamiento de los electrones en una reacción química, siguiendo un conjunto de reglas que se especificarán más adelante. Normalmente el estado de oxidación es un número entero pero puede ser fraccionado, tal como +8/3 para el hierro en la magnetita (Fe3O4).
