¿Alguna vez te has preguntado por qué tu zapato izquierdo no encaja en el pie derecho? Aunque parecen iguales, son versiones «en espejo» el uno del otro. En química, este concepto se llama quiralidad, y hoy vamos a entenderlo usando solo materiales que tienes en tu cocina.
Conceptos Clave para no perderse
Antes de empezar, definamos a nuestros protagonistas:
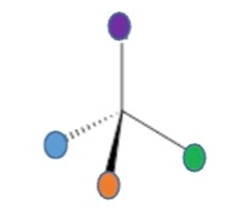
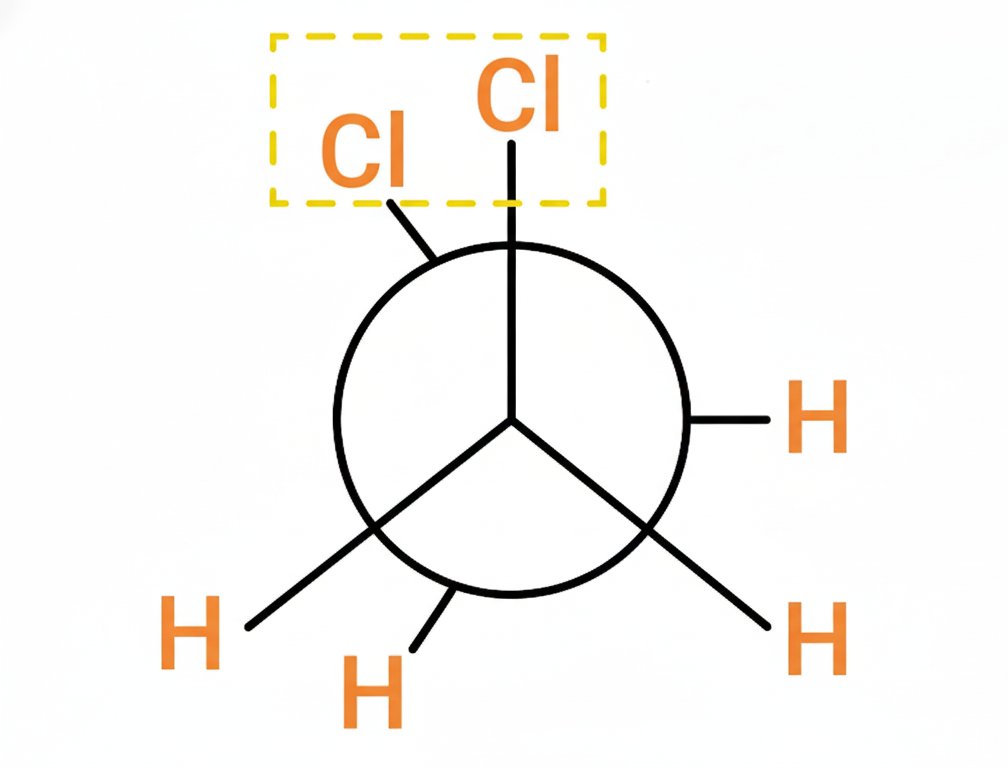
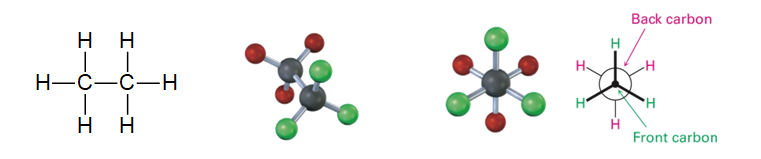
- Quiralidad: Propiedad de un objeto de no ser superponible con su imagen especular (como tus manos).
- Enantiómeros: Pareja de moléculas que son imágenes especulares entre sí (como la mano derecha e izquierda).
- Diasterómeros: Isómeros que tienen una parte igual y otra diferente, pero no son imágenes exactas frente al espejo.
Práctica de Laboratorio
Objetivo: Construir modelos moleculares para diferenciar visualmente los tipos de isómeros.
Materiales:
- Gomitas de colores (o malvaviscos/fruta picada en cubos).
- Palillos de dientes (mondadientes).
- Un espejo pequeño.
Leer más…«Laboratorio en Casa: El Espejo de las Moléculas (Quiralidad y Estereoisómeros)»