Las velas son símbolo de luz y calidez. Pero detrás de su llama hay un proceso químico fascinante que explica sus colores.
- Parafina: mezcla de hidrocarburos que se oxidan al quemarse.
- Zonas de la llama:
- Azul → combustión completa (alta temperatura).
- Amarillo → partículas de carbono incandescentes.
- Naranja/rojo → menor temperatura, combustión incompleta.
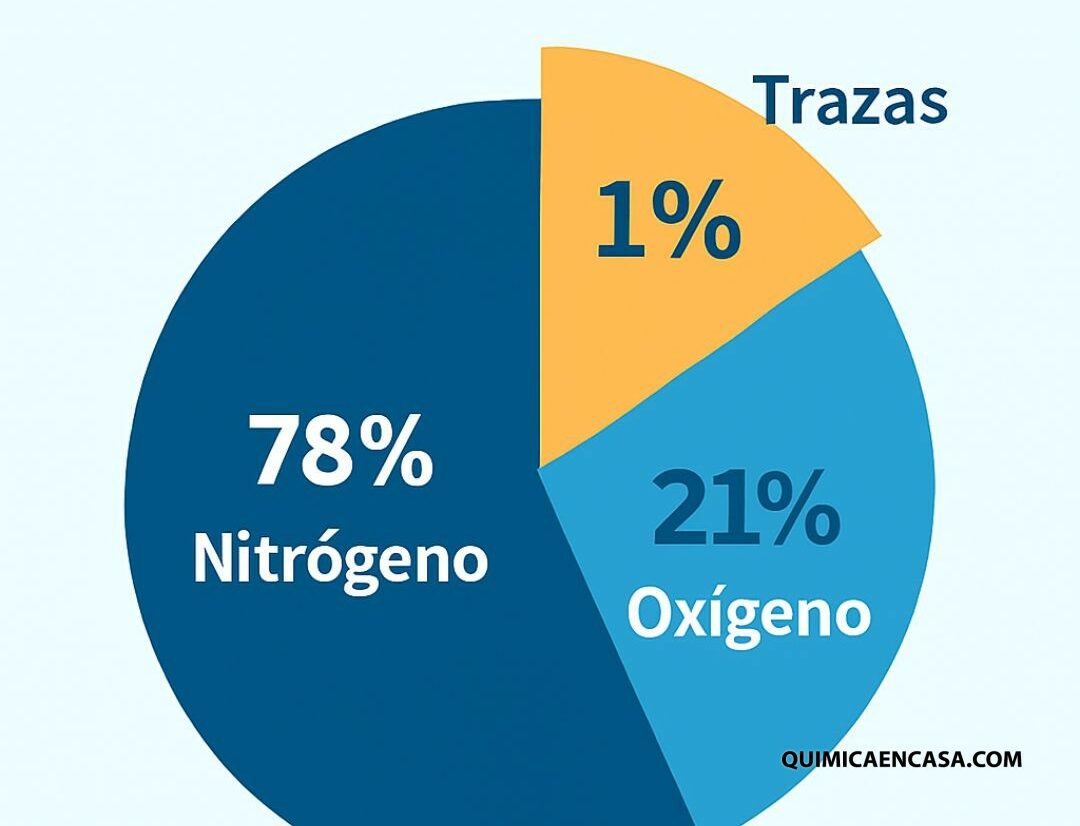
- Oxígeno: determina la intensidad y el color.
Leer más…«La química de las velas: por qué la llama tiene colores»