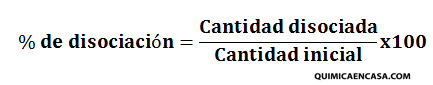Descubre cómo las reacciones químicas encuentran su propio balance

¿Por qué un refresco pierde gas?
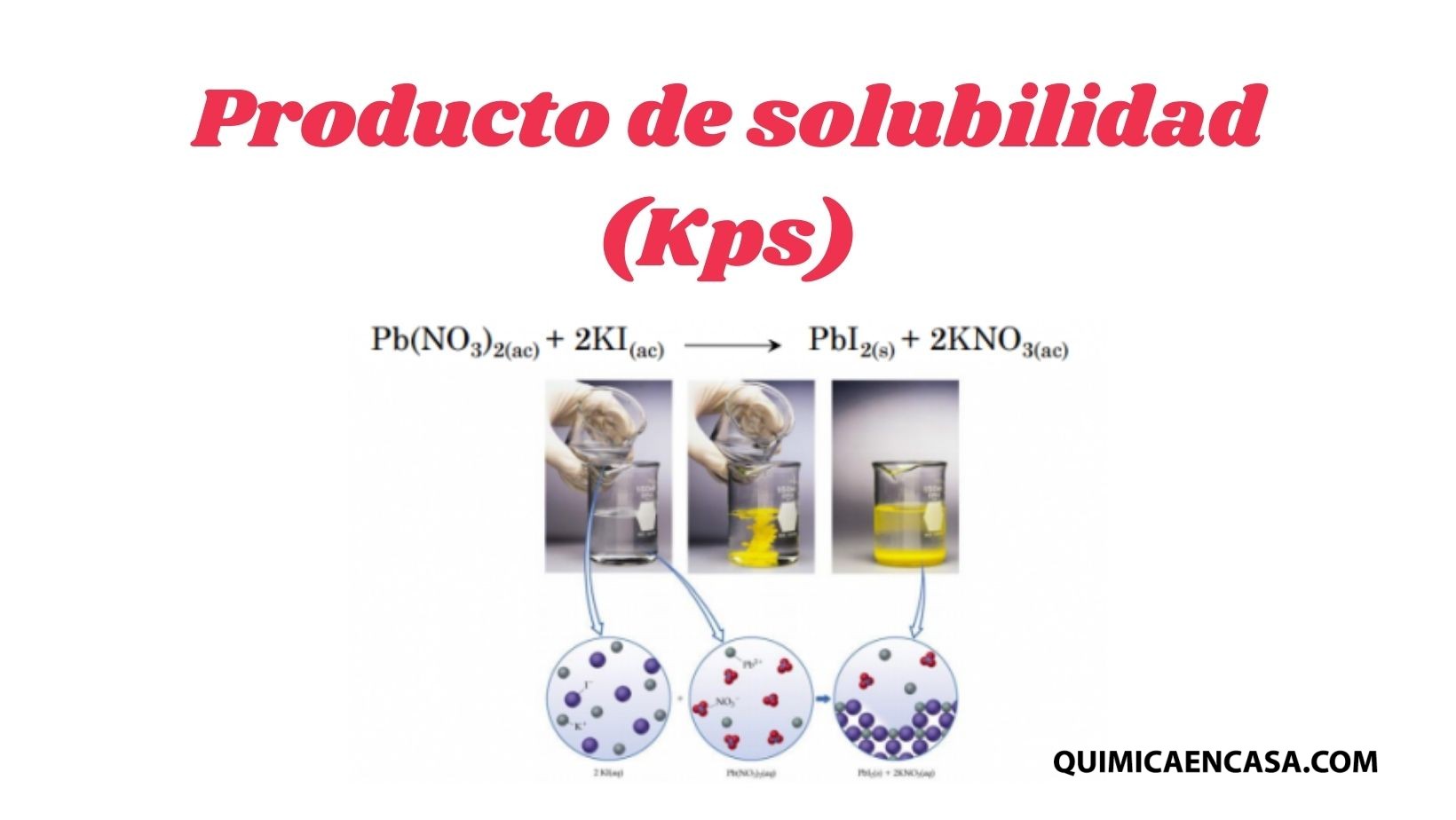
Cuando abres una botella de refresco, el gas escapa. Pero si la cierras, parte del gas vuelve a disolverse. Este fenómeno es un ejemplo cotidiano de equilibrio químico, un concepto fascinante que explica cómo las reacciones se ajustan solas para mantener estabilidad.
¿Qué es el equilibrio químico?
Es el punto en una reacción reversible donde la velocidad de la reacción directa (formación de productos) es igual a la velocidad de la reacción inversa (reformación de reactivos). No significa que las cantidades sean iguales, sino que no cambian con el tiempo.
- Ejemplo clásico:
N2 + 3H2 →2NH3
(Síntesis del amoníaco – proceso de Haber)
La constante de equilibrio (Kc)
La constante de equilibrio indica cuánto producto se forma en una reacción. Se calcula con las concentraciones de reactivos y productos:
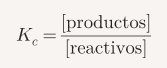
- Si Kc > 1, se favorecen los productos.
- Si Kc < 1, se favorecen los reactivos.