A simple vista parece magia: colocas un cubito de hielo en agua… y ¡flota! Pero detrás de esta escena cotidiana hay principios químicos fascinantes que hacen del hielo una rareza entre los sólidos.
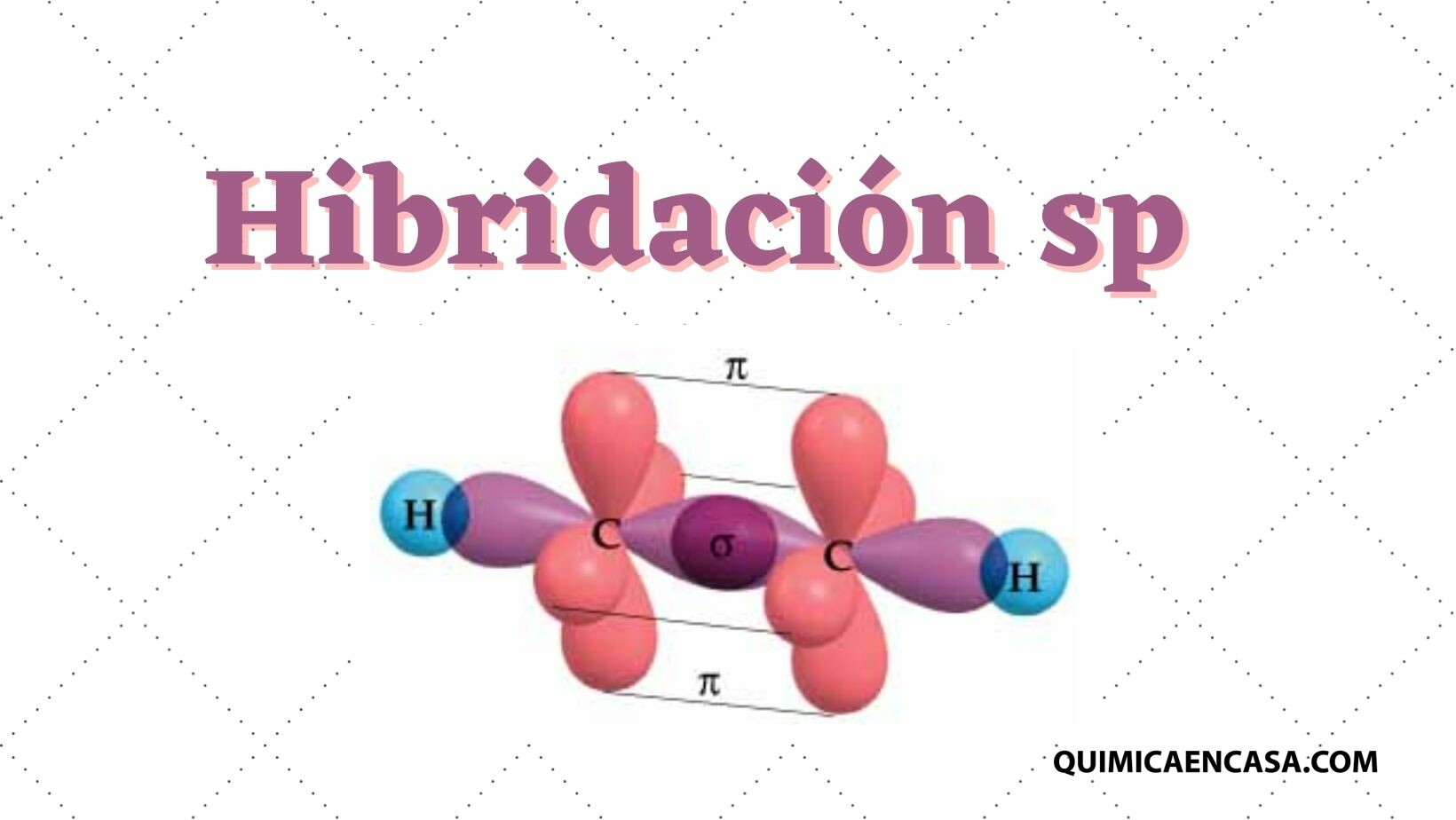
Enlace de hidrógeno: la clave del comportamiento del agua
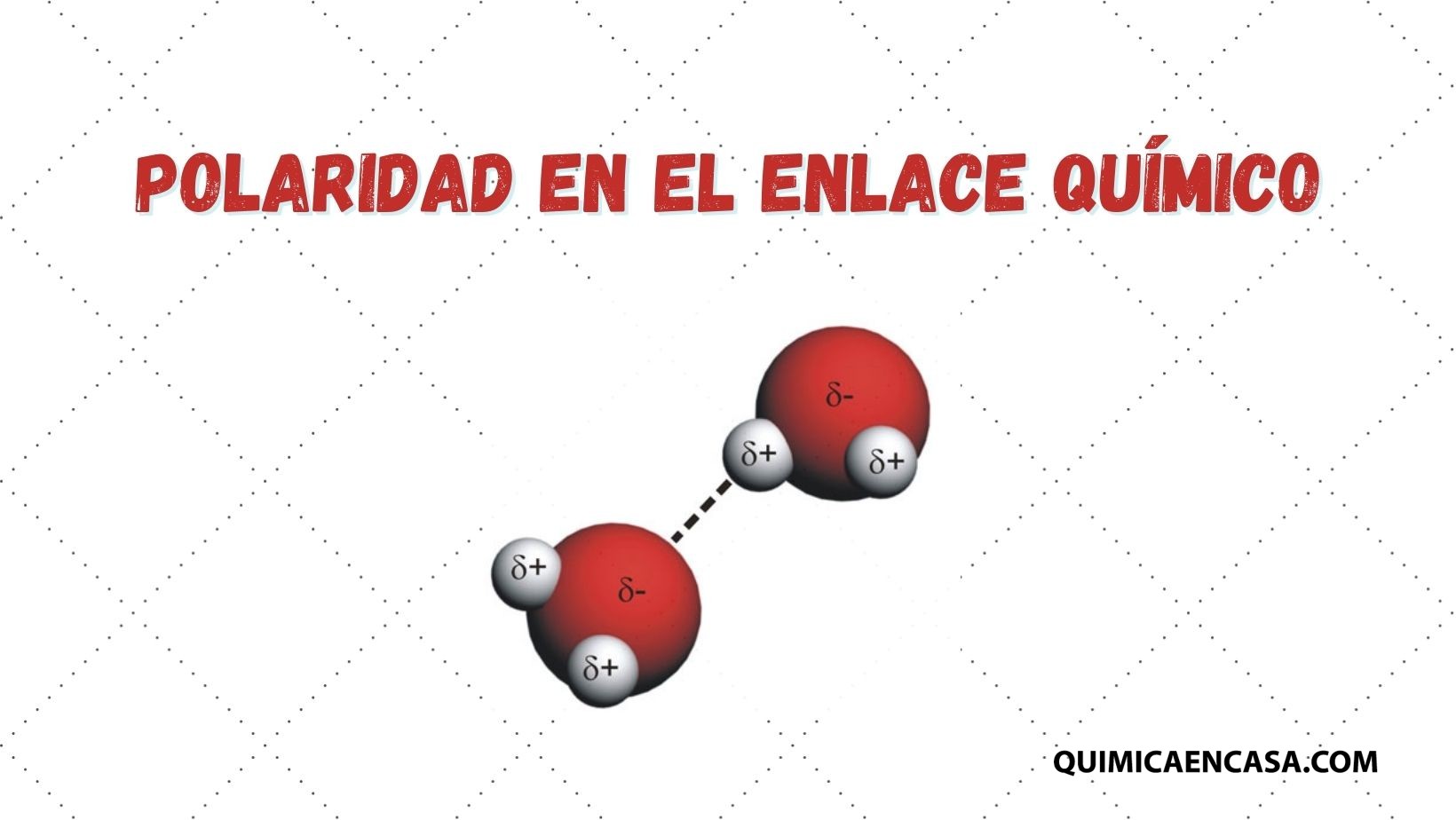
El agua es una molécula pequeña pero peculiar. Gracias a sus enlaces de hidrógeno, sus moléculas se mantienen unidas de forma flexible. Cuando el agua se congela, estos enlaces se organizan en una estructura cristalina que ocupa más espacio, haciendo que el hielo sea menos denso que el agua líquida.Leer más…«¿Por qué el hielo flota? La química escondida en un vaso de agua»