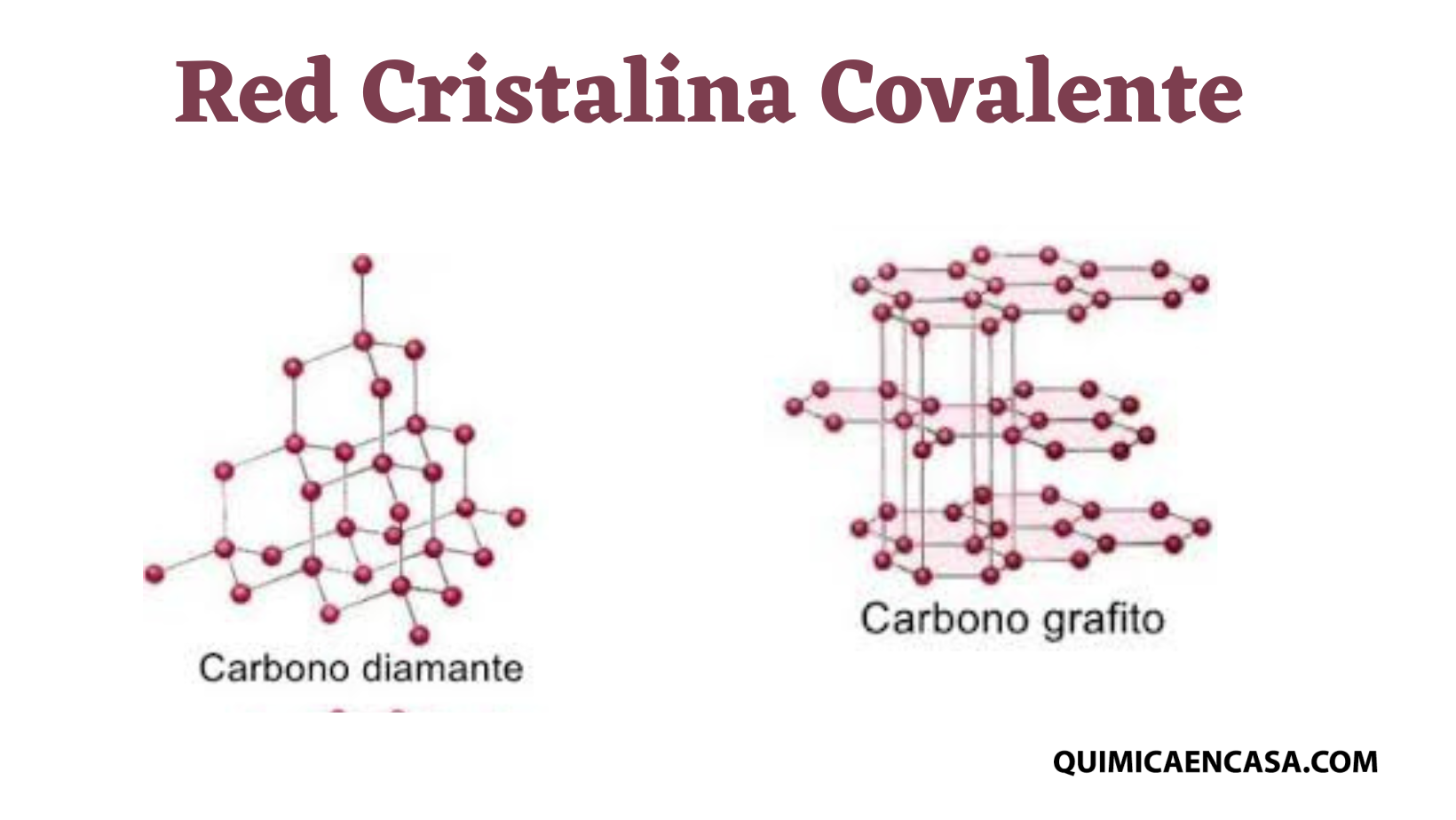
Como ya vimos anteriormente, los sólidos cristalinos son aquellos que poseen átomos o moléculas que están dispuestos de manera tal que forman una estructura completamente definida y ordenada, completamente diferente a los sólidos amorfos. Ahora bien, existen diferentes tipos de sólidos cristalinos, los cuáles se derivan según el tipo de enlace que estos presenten.
Estos se clasifican en sólidos covalentes o reticulares, sólidos iónicos, sólidos moleculares y sólidos metálicos.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míSólidos Covalentes
Este tipo de sólidos consiste en la unión de átomos de manera covalente con sus átomos contiguos en toda la prolongación del sólido. Los enlaces covalentes son los encargados de constituir el orden, conservar los átomos y lograr que estos estén bien unidos en sus posiciones espaciales de forma adecuada.
Propiedades
- Son bastante duros
- Presentan puntos de fusión muy altos
- Poseen baja conductividad térmica y eléctrica
- Alta fragilidad
- Baja solubilidad
Ejemplos
Diamante, grafitos, cuarzo, silicio, nanotubos de carbono, entre otros.
Diamante
El diamante es un sólido que posee una red cristalina del tipo covalente, donde los carbonos forman hibridación sp3, y cada átomo está enlazado a otros cuatros a través de enlaces covalentes, formando una estructura con gran simetría, ya que todos sus enlaces son iguales.
Es uno de los materiales más duro que existe, debido a la distribución de sus enlaces que forman una red tridimensional bastante fuerte, con cada átomo unido a otros cuatro formando una geometría tetraédrica.


