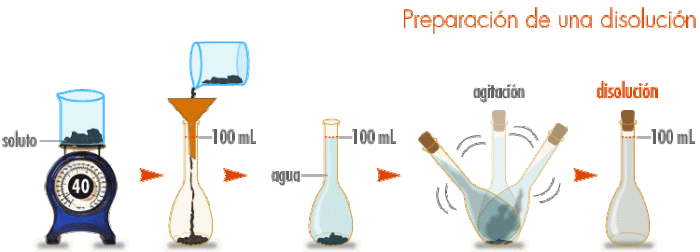
Las unidades químicas a diferencia de las unidades físicas de concentración, relacionan el mol de soluto que presenta las soluciones, en este caso, que estudiaremos la molaridad (mol/L), el mol se relaciona con el volumen de la solución en litros.
Molaridad
Se define como la cantidad de mol de soluto entre el volumen de la solución en litros. Se designa con la letra M mayúscula, aunque en la actualidad se le conoce como simplemente concentración mol/L.
La fórmula que se utiliza para calcular la concentración molar es la siguiente:

¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míO en la fórmula desarrollada: M = gramos de soluto
Masa molar x V (L)
Ejercicios
- Determinar la molaridad de una disolución formada al disolver 25 gramos de NaOH en 350 gramos de agua, si la densidad de esta solución es de 1100 kg/m³.
DATOS.
M = ?
g soluto = 25g
g solvente = 350g
ρ = 1100 kg/m³
Masa molar del NaOH = 40 g/mol
M = gramos de soluto
Masa molar x V (L)
Si observamos la fórmula anterior, sólo disponemos de los gramos de soluto y la masa molar para calcular la molaridad y es necesario buscar el volumen de solución; para ello lo relacionamos con la densidad. Entonces partimos de la fórmula de densidad, la cual no es más que la relación entre la masa y el volumen de la solución. Así que primero que nada buscaremos calcular la masa de dicha solución sumando la masa del soluto con la masa del solvente, quedando así:
m solución = m soluto + m solvente
m solución = 25 g + 350 g
m solución = 375 g
Ahora bien, como tenemos la densidad y la masa de la solución, se puede despejar de la fórmula el volumen:
ρ = m/ v
V = m/ ρ
Como la densidad está en Kg, transformamos la masa de la solución de gramos a kilogramos y nos queda igual a 0,375 Kg. Sustituimos en la fórmula:
v = 0,375 kg / 1100 kg/m³
V = 0,000341 m³
El volumen debe estar expresado en litros:
1 m³ equivale 1000 litros, entonces queda igual a 0,341 litros.
Por último calculamos la molaridad utilizando la fórmula desarrollada:
M = 25 g
40g /mol x 0,341 L
M = 1,83 mol/L
2. Calcular los gramos de HCl que se requieren para preparar 500 ml de solución al 0,5 M.
DATOS.
g soluto = ?
V solución = 500 ml = 0,5 L
M = 0,5 mol/L
MM HCl = 36,46 g/mol
Usando la fórmula desarrollada nos queda:
gramos de soluto = M x Masa molecular x V (L)
gramos de soluto = 0,5 mol/L x 36,46 g/mol x 0,5 L
gramos de soluto = 9,12 g de HCl