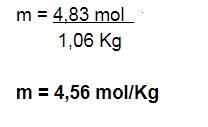La molalidad se refiere al número de mol de soluto que se encuentra disuelto en un kilogramo de solvente. Por lo tanto, su unidad es mol/kg y se designa con la letra “m” minúscula. Por ejemplo: Si una solución presenta una concentración 5 molal, significa que contiene 5 mol de soluto en cada kilogramo de solvente. La expresión matemática empleada para calcular la molalidad es:

Ejercicios Resueltos.
- Calcule la molalidad de una solución que se prepara disolviendo 12 gramos de hidróxido de aluminio Al(OH)3 en 350 gramos de agua. Masa molar Al(OH)3= 78 g/mol.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míDatos:
m = ?
masa soluto = 12 g
masa solvente = 350 g
Masa molar Al(OH)3= 78 g/mol
Paso N° 1: Cálculo del número de mol de soluto
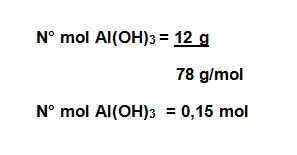
Paso N° 2: Transformar gramos de solvente a kilogramos
1 Kg ————– 1000 g
X ————- 350 g
X = 0,35 Kg
Paso N° 3. Cálculo de la Molalidad

2. Calcula la molalidad de una disolución de HBr al 27% m/m de densidad 1,45g/ml. Masa molar del HBr = 81 g/mol.
Datos.
m = ?
%m/m = 27%
ρ= 1,45 g/ml
MM HBr = 81 g/mol
Paso N° 1: Hallar la masa de la solución a través de la densidad de la solución

Nota: *Como no nos indican el volumen de la solución, asumimos que es 1 L= 1000 ml*
masa solución = 1,45 g/ml x 1000 ml
masa solución = 1450g
Paso N° 2: Hallamos la masa de soluto utilizando el %m/m
1450 g solución ————- 100%
X soluto ———————– 27 %
X = 391,5 g soluto
Paso N° 3: Calculamos la masa de solvente
Masa solución = masa soluto + masa solvente
Masa solvente = masa solución – masa soluto
Masa solvente = 1450g – 391,5g
Masa solvente = 1058,5g
Paso N° 4: Transformamos los gramos de solvente a kilogramos
1 Kg ————– 1000 g
X ————- 1058,5g
X = 1,06 Kg solvente
Paso N° 5: Calculamos los moles de soluto
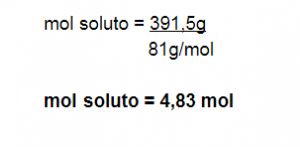
Paso N° 6: Hallar la molalidad