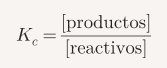Los valores de pKa son importantes porque nos permiten predecir si una reacción realmente va a ocurrir o si se quedará «quieta». La clave aquí es comparar la fuerza de los ácidos usando el valor de pKa.
Pasos para resolver los ejercicios
- Identificar los ácidos. Para ello debemos saber que los ácidos de Bronsted-Lowry son aquellos que donan un protón de hidrógeno y los ácidos conjugados son aquellos que resultan cuando la base acepta el protón de hidrógeno.
- Comparar los ácidos usando los valores de pKa.
- Analizar los valores de pKa y determinar sí la reacción química es o no posible.
Para ello debemos tomar en cuenta lo siguiente:
- Ácido fuerte → pKa bajo.
- Ácido débil → pKa alto.
La Regla de Fundamental para Predecir Reacciones
En química, la naturaleza es «perezosa», es decir, siempre prefiere ir de lo más inestable (fuerte/reactivo) a lo más estable (débil/tranquilo). Por eso, el equilibrio siempre favorece la formación del ácido más débil (el que tiene el pKa más alto).
Leer más…«Predicción de reacciones ácido-base usando valores de pKa»