
El porcentaje de disociación es la relación que existe entre el ácido o base disociada y la cantidad inicial del mismo, multiplicado por 100. Matemáticamente se expresa de la siguiente manera:
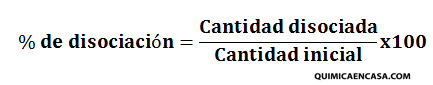
Otra expresión que refleja la cantidad de especie que se encuentra disociada es grado de disociación alfa (α), que representa la relación entre la cantidad de ácido o base disociada y la cantidad inicial.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí
Por ejemplo
- Determine la concentración de las especies químicas en equilibrio y el porcentaje de disociación para una solución 0,5 molar (mol/L) de ácido acético (CH3COOH) si la constante de disociación (Ka) es de 1,8×10-5
CH3COOH ↔ CH3COO– + H+
Paso 1. Primeramente se debe plantear la expresión de la constante de equilibrio.
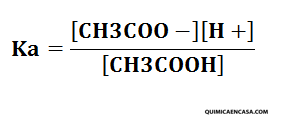
Paso 2. Ahora se debe determinar las concentraciones de cada una de las especies químicas en función de la concentración inicial.
|
CH3COOH |
CH3COO– | H+ | |
| Inicio |
0,5 mol |
0 |
0 |
| Equilibrio | 0,5-X | x |
x |
Paso 3. Se debe calcular la fracción disociada que en este sería nuestra incógnita X, sustituyendo en la expresión de equilibrio.
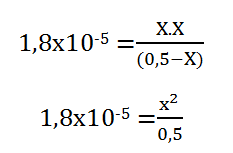
(1,8×10-5. 0,5) = X2
√0,9×10-5 = X
X= 3×10-3 = 0,003
Sustituimos el valor de X en cada una de las concentraciones de las especies:
[H+] = X = 0,003 Molar
[CH3COO–] = X = 0,003 Molar
[CH3COOH]= 0,5-X = 0,5-0,003 Molar
[CH3COOH] = 0,497 ≈ 0,5 Molar
Paso 4. Finalmente se halla el porcentaje de disociación, usando la siguiente fórmula:

REFERENCIAS
Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág.122). Fundación Editorial Salesiana.

