Este método consiste en igualar el número y clase de átomos, iones o moléculas de los reactantes con los productos, con la finalidad de cumplir la ley de conservación de la masa.
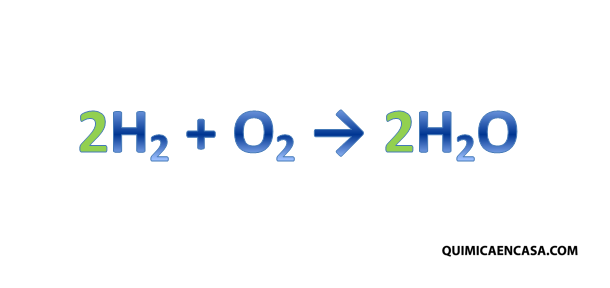
Reglas para el balanceo por tanteo
- Toda ecuación química consta de reaccionantes y productos.
- Para balancear una ecuación química se colocan delante de las fórmulas, unos números llamados coeficientes, de tal manera que el número de átomos en ambos miembros de la ecuación sea exactamente igual.
- El coeficiente 1 no se coloca, ya que se sobreentiende.
- Los coeficientes afectan a toda la sustancia que preceden.
- Los coeficientes multiplican a los sub-índices que presentan las fórmulas.
- En caso de que un compuesto tenga paréntesis, el coeficiente multiplicará al sub-índice y luego este multiplicará a los sub-índices que están dentro del paréntesis.

- El hidrógeno y el oxígeno se balancean al final (aunque hay excepciones) porque generalmente forman agua (sustancia de relleno).
- En algunos casos es recomendable empezar a balancear los metales, luego los no metales (que no sean oxígeno e hidrógeno), seguido del oxígeno y finalmente el hidrógeno.
Ejercicios Resueltos
1.- Ca + HCl → CaCl2 + H2
Esta es muy sencilla, como podemos observar el hidrógeno y el cloro están desbalanceados.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míDel lado de los reactantes hay:
Ca = 1
H = 1
Cl= 1
Del lado de los productos hay:
Ca = 1
H = 2
Cl= 2
Entonces se debe colocar un coeficiente que al multiplicarlo por 1 de como resultado 2, del lado donde está la deficiencia de átomos, que en este caso seria el de los reactantes. Por tal razón, se coloca un 2 adelante del HCl, quedando:
Ca + 2HCl → CaCl2 + H2
2.- Al + O2 → Al2O3
Del lado de los reactantes tenemos:
Al= 1
O= 2
Del lado de los productos tenemos:
Al= 2
O=3
En este caso todas las sustancias están desbalanceadas. Como se puede observar, el oxígeno está desbalanceado y de un lado tenemos un número par y del otro un número impar. Cuando sucede así, recomiendo empezar por el oxígeno y multiplicar en el lado impar, por un número par para así obtener otro número par:
Al + O2 → 2Al2O3
Ahora queda del lado de los productos:
Al = 4
O= 6
Finalmente balanceo del lado de los reactantes colocando coeficientes tanto en el oxígeno como en el aluminio:
4Al + 3O2 → 2Al2O3
3.- Fe + H2SO4 → Fe2 (SO4)3 + H2

En este caso empezaremos balanceado el metal (el hierro).
2Fe + H2SO4 → Fe2 (SO4)3 + H2
Luego el no metal (azufre)
2Fe + 3H2SO4 → Fe2 (SO4)3 + H2
Para luego balancear el oxígeno y el hidrógeno.
2Fe + 3H2SO4 → Fe2 (SO4)3 + 3H2
4.- P2O5 + H2O → H3PO4
Del lado de los reactantes tenemos:
P= 2
O= 6
H=2
Del lado de los productos tenemos:
P= 1
O= 4
H=3
Para esta ecuación, empezaremos balanceando el fósforo:
P2O5 + H2O → 2H3PO4
Para luego balancear el oxígeno y el hidrógeno:
P2O5 + 3H2O → 2H3PO4
-
Balancee por tanteo las siguientes ecuaciones químicas:
1.- Mn2O7 → MnO2 + O2
2.- Sb + HCl → SbCl3 + H2
3.- PbS + O2 → PbO + SO2
4.- CaCO3 → CaO + CO2
5.- Fe(OH)3 + H2SO4 → Fe2 (SO4)3 + H2O

