
La molaridad es una de las formas más usadas para expresar concentración en química. Se define como la cantidad de mol de soluto disueltos en un litro de solución. En este ejercicio aprenderás a calcular la molaridad de una solución de hidróxido de sodio (NaOH) preparada en el laboratorio, siguiendo un método claro y sencillo.
Enunciado del ejercicio
¿Cuál es la molaridad de una solución preparada con 10 g de NaOH disueltos en 250 mL de agua?
Paso a paso para resolver
- Identificar los datos del problema
- Masa de NaOH: 10 g
- Volumen de solución: 250 mL = 0,250 L
- Masa molar del NaOH: 40 g/mol
- Calcular el mol de soluto
Usamos la fórmula:
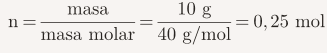
- Aplicar la fórmula de molaridad
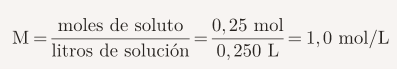
Tabla resumen del cálculo
| Magnitud | Valor |
| Masa de NaOH | 10 g |
| Masa molar de NaOH | 40 g/mol |
| Mol de NaOH | 0,25 mol |
| Volumen de solución | 0,250 L |
| Molaridad | 1,0 mol/L |
Diagrama conceptual del proceso
Gramos → Mol → Litros → Molaridad
Una línea de conversión directa que permite calcular la concentración de cualquier solución si conoces la masa del soluto y el volumen final.
La molaridad es una herramienta esencial en química para preparar soluciones con precisión. Este ejercicio muestra cómo convertir datos simples en una medida útil para experimentos, titulaciones y análisis químicos.

