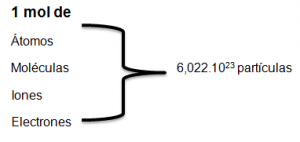
El mol es la unidad que se utiliza para referirse a la cantidad de sustancia que contiene un número fijo de partículas numéricamente igual al número de Avogadro, es decir igual 6,022.1023
El mol surge ante la imposibilidad de manipular y contar partículas tan pequeñas como los iones, átomos y moléculas, por lo cual se creó una unidad de cantidad de sustancia lo suficientemente grande y ponderable como para poder ser apreciada y manipulada por parte de los científicos en sus trabajos de investigación.
A principios del siglo XIX, Amedeo Avogadro investigó la relación entre la cantidad de moléculas o átomos de una sustancia y los moles. A través de sus estudios logró enunciar la llamada ley de Avogadro, donde señala que:
«Volúmenes iguales de gases distintos bajo las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas».
Siguió con dicha investigación y desarrolló la teoría atómica, y en su honor se le dio el nombre al número de Avogadro.
¿De dónde surge el número de Avogadro?
La constante de Avogadro se origina de estudios previos que tienen relación a la apreciación del diámetro medio de las moléculas en el aire por un procedimiento similar a calcular el número de partículas en un volumen de un gas determinado. La constante de Loschmidt, que no es más que la densidad numérica de partículas en un gas ideal, es aproximadamente proporcional a la constante de Avogadro.
Pero ¿qué significa que en un mol de una sustancia haya 6,022.1023 partículas?
Esto se puede explicar mediante el siguiente ejemplo: En un mol de agua (H2O) hay 6,022.1023 moléculas de H2O, es decir, 2 × 6,022.1023 átomos de hidrógeno y 6,022.1023 átomos de oxígeno.
De forma cuantitativa, el mol se puede calcular haciendo uso de la fórmula siguiente:
mol = gramos de la sustancia
Masa atómica/ Masa molar
La masa molar es la masa de un mol de una sustancia. Su unidad es g/mol. En el caso de sustancias como elementos se utiliza la unidad g/atm-g, es decir gramos/átomo-gramo.
Ejercicios:
- ¿Cuántos átomos de hidrógeno están contenidos en 25 g de hidrógeno?
Datos:
n° de gramos = 25g
Masa atómica de H= 1 g/atm-g
n° de átomos = X
número de mol de átomos = 25g ÷1g/atm-g
número de mol de átomos = 25 atm-g
1 atm-g → 6,022.1023 átomos
25 atm-g → X
X=1,50.1025 átomos de hidrogeno
- ¿Cuántas moléculas de H2SO4 están contenidas 36 g de dicho compuesto?
Datos:
n° de gramos = 36g
Masa molar H2SO4= 98 g/mol
n° de moléculas = X
número de mol de moléculas = 36g ÷98g/mol
número de mol de moléculas = 0,367 mol de H2SO4
1 mol → 6,022.1023 moléculas
0,367mol → X
X=2,21.1023 moléculas de H2SO4
- ¿Cuántos gramos de NaOH están contenidos en 4,5.1024 moléculas de dicho compuesto?
Datos:
n° de gramos = X
Masa molar NaOH= 40 g/mol
n° de moléculas = 4,5.1024 moléculas
1 mol → 6,022.1023 moléculas
X → 4,5.1024 moléculas
X= 7,47mol de NaOH
Número de mol = gramos de la sustancia / Masa molar
gramos de la sustancia = Número de mol x Masa molar
gramos de NaOH = 7,47 mol x 40 g/mol
gramos de NaOH= 298.8 g


