En química orgánica, no basta con saber qué átomos están conectados; la orientación espacial de esos átomos (su conformación) es crucial. Las moléculas no son estáticas; giran constantemente alrededor de sus enlaces simples. Para entender esta «danza», los químicos usan las Proyecciones de Newman.
¿Qué son las Proyecciones de Newman?
Son una forma de representar las conformaciones de una molécula observando a lo largo de un enlace carbono-carbono específico. Nos permiten visualizar los grupos unidos a esos dos carbonos y cómo interactúan entre sí.
- La Visión: Imagina que miras directamente por encima de un enlace C-C.
- El carbono frontal se representa como un punto en el centro.
- El carbono trasero se representa como un círculo grande que rodea el carbono frontal.
- Los grupos unidos a cada carbono se dibujan saliendo de ese punto o círculo.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míTipos de Conformaciones Principales
Para moléculas simples como el etano (CH₃-CH₃) o el n-butano (CH₃CH₂-CH₂CH₃), nos interesan principalmente dos tipos:
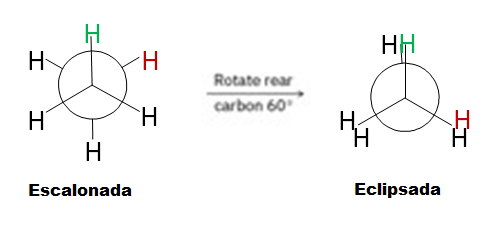
- Conformación Eclipsada (Eclipsed):
- Descripción: Los grupos unidos al carbono frontal están directamente alineados con los grupos unidos al carbono trasero. Si los miras desde arriba, parece que se superponen.
- Estabilidad: Es la conformación menos estable y de mayor energía. La razón es la «tensión torsional» (o tensión de Pitzer): las nubes de electrones de los enlaces C-H o C-C en el carbono frontal repelen a las del carbono trasero, creando una repulsión electrostática.
- Conformación Escalonada / Alternada (Staggered):
- Descripción: Los grupos unidos al carbono frontal están «escalonados» o se encuentran entre los grupos unidos al carbono trasero, minimizando la superposición.
- Estabilidad: Es la conformación más estable y de menor energía. La tensión torsional es mínima porque los electrones están lo más lejos posible entre sí.
EJERCICIO RESUELTO
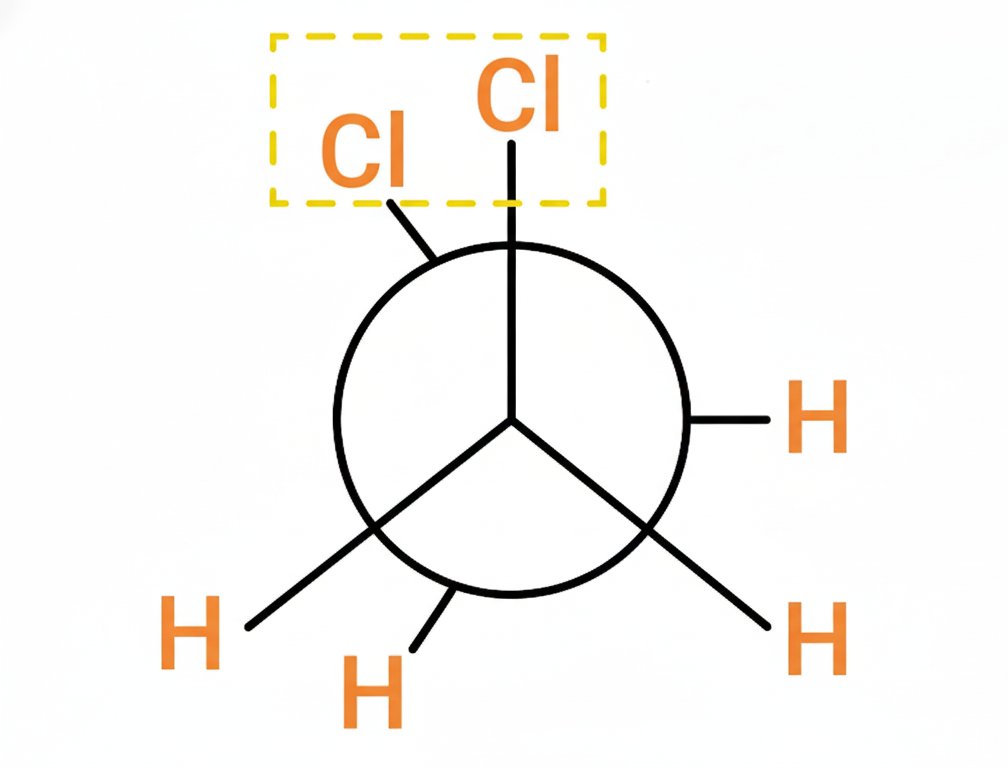
- Realiza las proyecciones de Newman para el compuesto 1-cloropropano, en sus carbonos: C1-C2
Después de casi una década escribiendo para ustedes, sé que no hay nada como un buen diagrama hecho a mano para entender la química orgánica. Por eso, hoy he decidido dejar de lado las representaciones por computadora de las Proyecciones de Newman y traerles mis propios trazos para asegurar que la precisión científica sea absoluta. Lo siento si mis dibujos no son los más estéticos jaja.
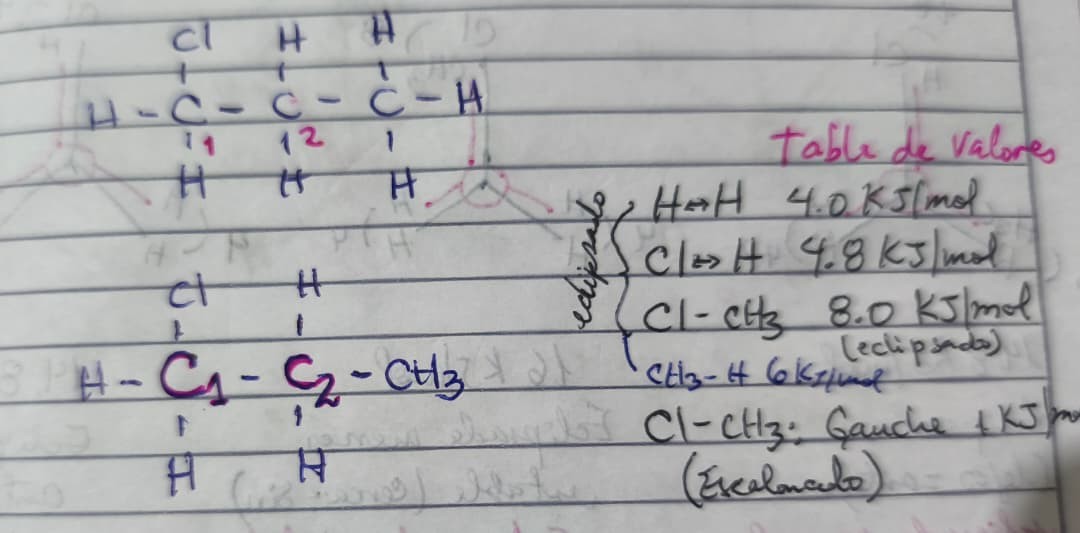
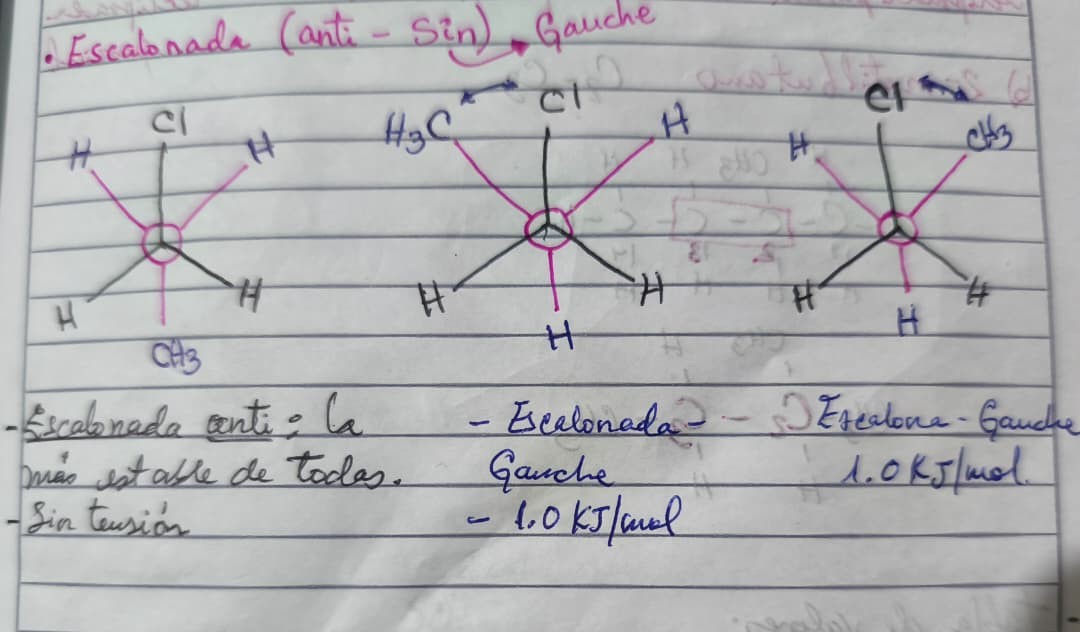
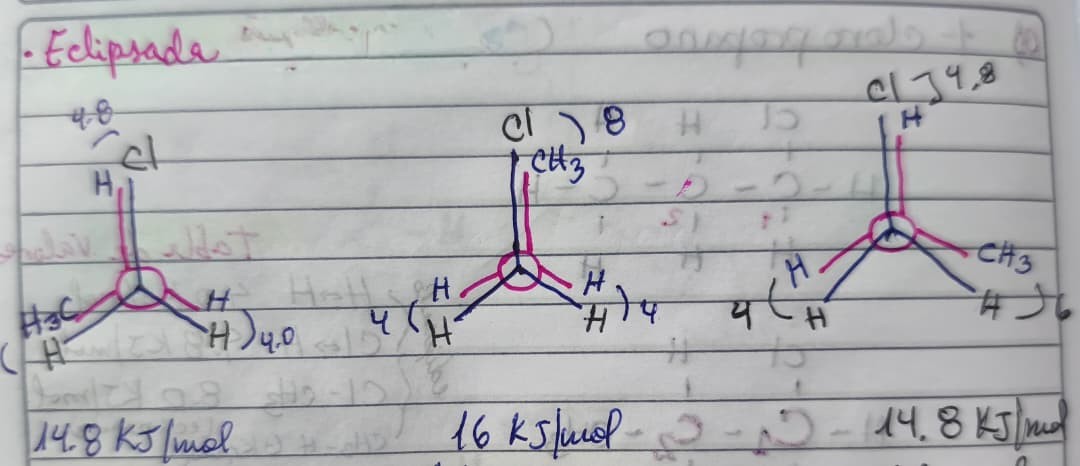
CONCLUSIONES
- Las proyecciones escalonadas son más estables que las eclipsadas.
- La escalonada anti es la más estable de todas ya que no presentan tensión.
- La escalonada gauche es la menos estable de las escalonadas. Tiene una tensión de 1.0 KJ/mol
- Las proyecciones eclipsadas son las menos estables. En este ejercicio, la menos estable es la eclipsada total con 16 KJ/mol de energía y las más «estables» de las eclipsadas es la eclipsada parcial con 14.8 KJ/mol de energía.
Ahora puedes practicar tú:
Realiza las proyecciones de Newman para el compuesto 2-metilbutano, en sus carbonos: C2-C3. Rellena el siguiente cuadro:
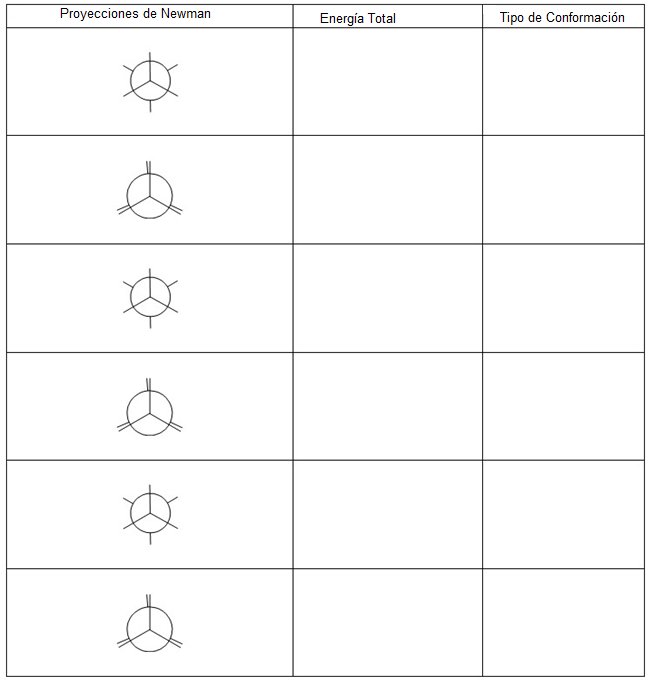
Datos que vas a necesitar para el cálculo de energía: