Esta propiedad nos permite conocer la capacidad que posee un átomo para atraer electrones hacia él cuando se haya formando parte de un enlace covalente. La electronegatividad predice la polaridad de los enlaces, de manera que es posible saber si se está en presencia de un enlace iónico o covalente.
Para el año 1932, el científico estadounidense, Linus Carl Pauling, concibió la idea de la electronegatividad de los elementos y definió dicha propiedad como la medida de la tendencia de un átomo para atraer electrones.
Para llegar a dicha conclusión, empleó numerosas características que presentan las moléculas, principalmente el momento dipolar y la energía requerida para fragmentar los enlaces.
Escala de Pauling
Linus Pauling implantó una escala que lleva su nombre «escala de Pauling», la cual es de gran utilidad ya que nos ayuda a predecir, casi en su totalidad, el comportamiento químico de los elementos químicos, específicamente en como se unen estos a otros elementos . El valor asignado por Pauling, de manera arbitraria, va de 0,7 a 4, siendo los valores más pequeños los que se le asigna a los elementos menos electronegativos y los valores más altos a los elementos más electronegativos. El elemento más electronegativo de la tabla periódica es el flúor y este presenta una electronegatividad de 4 según la escala de Pauling. Por su parte, los elementos cesio y francio son los menos electronegativos con un valor de 0,7.
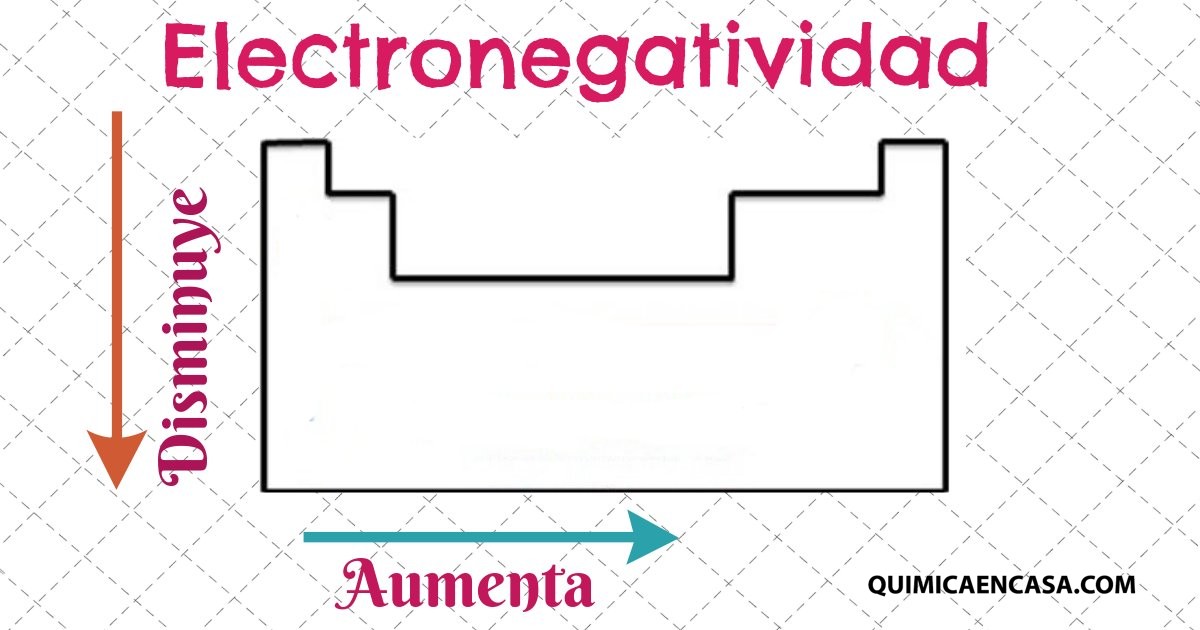
Comportamiento de los átomos en los grupos y periódos, según su electronegatividad
Al comparar átomos con diferentes radios, se observa que una disminución de los mismos refuerza la atracción de los electrones por el núcleo, lo que ocasiona un aumento en la electronegatividad. Entonces los elementos que se encuentran ubicados en el mismo periodo pero diferente grupo, veremos que la electronegatividad aumentará de izquierda a derecha.
Por el contrario, los elementos que se hayan ubicados en el mismo grupo, mostraran una disminución de electronegatividad en la medida que aumenta el periodo.
Por ejemplo
Ordene de forma creciente a los siguientes elementos en función a su electronegatividad:
Z=27, Z= 20, Z=53
Ca< Co < I
El calcio presenta una electronegatividad de 1.0, el cobalto de 1.8 y el yodo de 2.5, según la escala de Pauling, siendo el menos electronegativo el calcio (se encuentra a la izquierda de la tabla periódica) y el más electronegativo es el yodo, el cual se haya a la derecha de la tabla periódica.
también te puede interesar:
Propiedades Periódicas: Radio Atómico

