Los cálculos estequiométricos son aquellos que se realizan para conocer con precisión la cantidad que se va a obtener de un determinado producto o las cantidades de reactivo que se necesitan para obtener un producto.

Por su parte, el porcentaje de rendimiento nos permitirá conocer la cantidad en porcentaje del producto obtenido en una reacción química.
Matemáticamente se puede expresar mediante la siguiente ecuación:
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí
- Calcule el porcentaje de rendimiento (%R) de la siguiente reacción química:
2N2 + 5O2 → 2N2O5
Si se hace reaccionar 40 g de N2 con 55 g de O2, y se obtienen experimentalmente 52 g de N2O5.
Pasos
- Calcular la masa molecular de las sustancias que forman parte de la reacción química:
N2= 28 g/mol
O2= 32 g/mol
N2O5 = 108,01 g/mol
- Calcular el reactivo limitante, confrontando los reactantes:
Primera relación
2 N2 → 5 O2
2mol x 28g/mol → 5 mol x 32 g/mol
40 g → x
56 g → 160g
40g → x
X= 114,29 g de O2
Segunda relación
2 N2 → 5 O2
2mol x 28g/mol → 5 mol x 32 g/mol
x → 55g
56 g → 160g
x→ 55g
x= 19,25 g de N2
De dichos cálculos se puede concluir que el reactivo limitante es el O2, porque de 55g que tiene inicialmente, no puede rendir con 114,29g que necesita. Por lo tanto, el reactivo en exceso es el N2.
- Determinar la masa teórica, confrontando el reactivo limitante con el producto:
5 O2 → 2 N2O5
5mol x 32g/mol → 2 mol x 108,01 g/mol
55 g → x
160 g → 216,02g
55g→ x
X = 74,26 g de N2O5
- Finalmente se calcula el porcentaje de rendimiento:
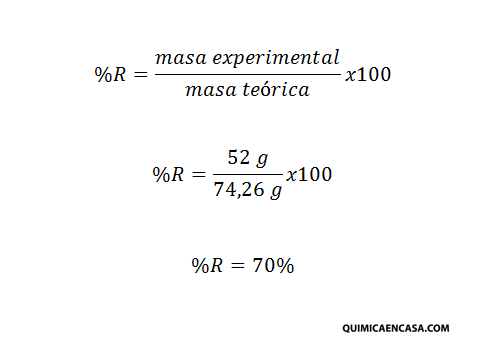
El porcentaje de rendimiento no puede ser mayor al 100%.

