
Los óxidos son compuestos inorgánicos formados por la combinación del oxígeno con algún otro elemento. Estos pueden presentarse en los tres estados de la materia: sólido, líquido y gaseoso. Son compuestos que se hallan de forma abundante en la corteza terrestre, como por ejemplo: el monóxido de nitrógeno, dióxido de nitrógeno, dióxido de carbono, entre otros.
Clasificación de los óxidos
Según su comportamiento químico:
Óxido básico. También llamados óxidos metálicos, son aquellos que surgen de la combinación de un metal con el oxígeno. Por ejemplo: Na2O
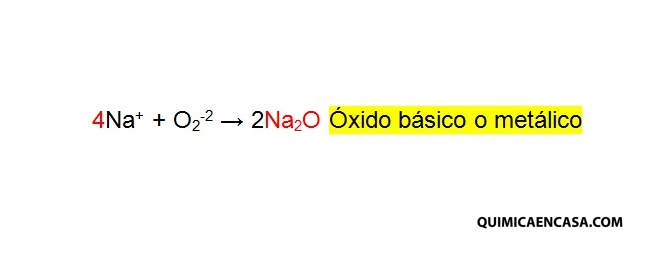
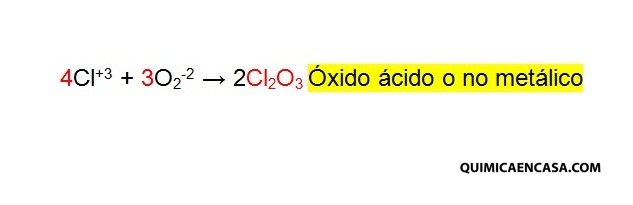
Óxido ácido. También llamados óxidos no metálicos, son aquellos que surgen de la combinación de un no metal con el oxígeno. Por ejemplo: Cl2O3
Óxido anfótero. Son aquellos óxidos formados por la combinación de un elemento anfótero y el oxígeno. Los elementos anfóteros son aquellos que actúan como ácidos y como bases. Algunos metales y metaloides poseen esta característica formando óxidos anfóteros como por ejemplo: zinc, plomo, aluminio, berilio y estaño. Por ejemplo: Al2O3
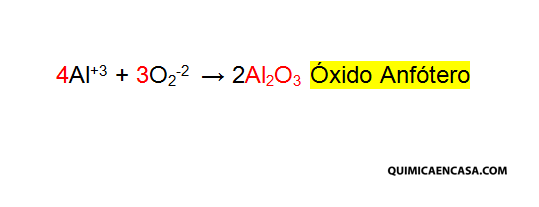
Según la estequiometria del óxido:
Óxidos binarios. Son aquellos que están compuestos por oxígeno y otro elemento. Es decir, todos los que se nombraron anteriormente.
Óxidos mixtos. Son aquellos que están constituidos por dos elementos distintos y oxígeno como por ejemplo el MgAl2O4, que es un mineral cuyo nombre es espinela.
Usos de algunos óxidos
El dióxido de carbono se utiliza en las bebidas gaseosas. También se emplean como agente extintor, en medicina para tratamientos estéticos y en el tratamiento de heridas craneales.
El óxido de zinc se emplea en la preparación de cremas cosméticas, protector solar, en la elaboración de maquillaje, jabones. talco, entre otros.
El óxido de cromo es utilizado como colorante, en la preparación de pinturas, tintes, entre otros.
El dióxido de titanio se emplean en la fabricación de pinturas, plásticos, papel, tintas de impresión, cosméticos, productos textiles, farmacéuticos y alimentarios.

