La ley combinada de los gases es aquella que unifica las leyes de Charles, la ley de Gay-Lussac y la ley de Boyle. En esta ley se relaciona las variables de presión, volumen y temperatura de una cantidad fija de un gas.
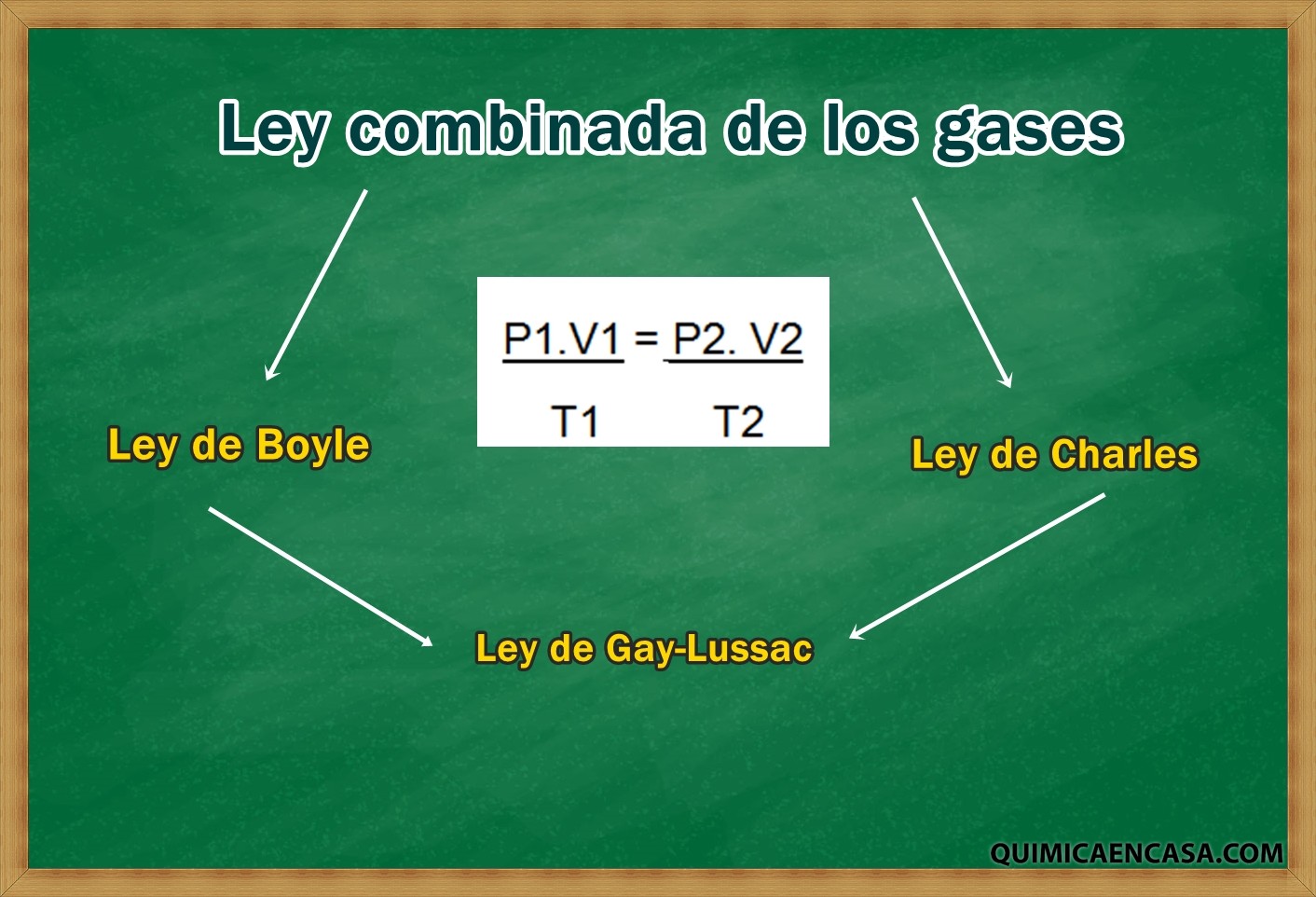
Esta combinación de leyes señala lo siguiente:
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí- La presión es inversamente proporcional al volumen y directamente proporcional a la temperatura.
- El volumen es directamente proporcional a su temperatura.
Por lo tanto, la ley de los gases combinados, establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
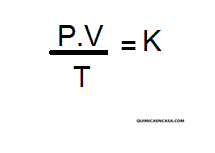

Unidades
- La temperatura debe ir expresada en Kelvin.
- El volumen debe estar expresado en litros.
- La presión debe estar expresada en atmósfera.
Ejercicios
- A la temperatura de 25 ºC y a la presión de 690 mmHg, cierta cantidad de oxígeno ocupa un volumen de 80 ml. ¿Cuál será el volumen ocupado por el gas en condiciones normales?
Datos.
T1 = 25 ºC + 273 = 298 K
P1 = 690 mmHg
V1 = 80 ml
V2= ?
Como nos están indicando que el gas que ocupa un recipiente, se encuentra en condiciones normales, los parámetros para la misma, es que la temperatura se encuentre a los 0 ºC = 273 K y la presión sea 760 mmHg = 1 atmósfera.
Entonces: P2 = 760 mmHg y T2 = 273 K
Despejamos V2 de la fórmula general y queda:
V1.P1.T2 = V2. P2. T1

Se realiza las sustituciones y operaciones correspondientes, quedando:
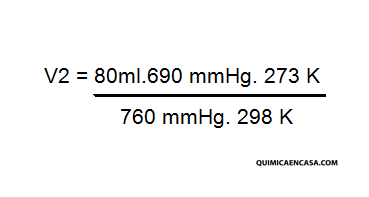
Finalmente, el volumen queda: V2 = 66,54 ml, lo cual en litros sería: 0,067 litros.
2. Un gas a O ºC y 600 mmHg de presión, tiene un volumen de 500 ml. Si la presión es aumentada a 800 mmHg y el volumen varía a 600 ml. Determine la nueva temperatura expresada en grados Celsius.
3. Un gas que ocupaba un volumen de 528 ml a la presión de 745 mmHg y a la temperatura de 12 ºC, fue dejado expandirse hasta que el volumen midió 890 ml a la temperatura de 30 ºC. ¿A qué presión estará sometido el gas?

