
Las sales, al igual que los ácidos y bases, son compuestos que tienen la particularidad de alterar la concentración de H+ y OH– que está presente en el agua. Estas al disolverse, poseen la capacidad de mezclarse con dichos iones, ocasionando un cambio en el pH de la solución.
La hidrólisis es el proceso de reacción con el agua, donde se establece un equilibrio.
Por ejemplo, una solución de cloruro de amonio en agua:
Etapa 1. Disociación del agua: Estado de equilibrio
H2O ↔ H+ + OH–
Igual número de H+ y OH–, pH= 7
Etapa 2. Disociación del cloruro de amonio
NH4Cl ↔ NH4+ + Cl–
Sin la presencia de H+ y OH–, por lo tanto, aparentemente no afecta el pH de la mezcla.
Etapa 3. Estado final
H2O ↔ H+ + OH–
NH4Cl ↔ NH4+ + Cl–
NH4+ + OH– ↔ NH4OH
El número de H+ en la mezcla, sin neutralizar aumentó, por lo tanto también la acidez. Se evidencia que el pH es menor a 7.
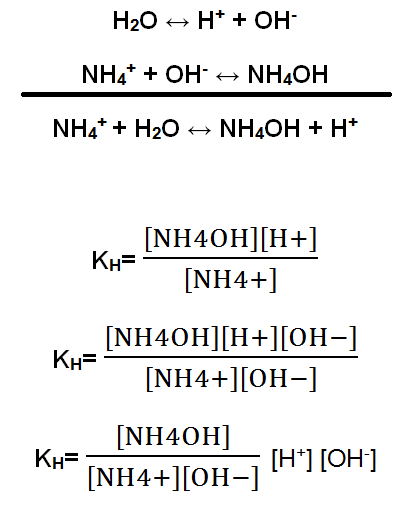
[OH–] = 1/Kb
[H+] [OH–] = KH2O
Al formarse una base débil:
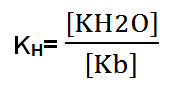
Al formarse un ácido débil:
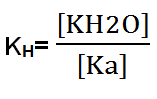
Si se considera que todos los iones hidroxilos (OH–) producidos por la ionización del agua se unen a los iones amonio (NH4+), entonces la ecuación que representa el proceso será la suma de la reacción de disociación del agua, y la reacción de combinación del ion amonio con el OH–. La expresión de equilibrio, que recibe el nombre de constante de hidrólisis (KH), contempla las especies en la reacción, con excepción del agua líquida.
Ahora bien, la expresión se multiplica por OH– en el numerador y denominador, sin modificar la fórmula. Finalmente, se obtiene una fórmula de la KH que contiene la constante de disociación del agua (KH2O) y la constante básica (Kb). La constante KH2O es igual a 1×10-14.
Estas expresiones permiten los cálculos necesarios para determinar las concentraciones de los iones, y el pH de la solución, tanto formándose una base débil como un ácido débil, que puede ocurrir si los iones hidronio (H+) son captados por un anión, quedándose iones hidroxilos (OH–) libres en el medio, resultando un pH mayor de 7. Un ejemplo de esto sería una solución de acetato de sodio en agua.
Ejercicio Resuelto
- Determinar el pH de una solución de cloruro de amonio 1,5 molar, sabiendo que el valor de la constante básica (Kb) para el ión amonio es 1,8×10-5.
NH4+ + H2O ↔ NH4OH + H+
Resolución:
Paso 1. Se inicia realizando el cálculo de la constante de hidrólisis a partir de la constante de disociación del agua y de la constante básica.

Paso 2. Determinar las concentraciones de cada una de las especies químicas en función de la concentración inicial.
| NH4+ | H2O | NH4OH | H+ | |
| Inicio | 1,5 M | Exceso | 0 | 0 |
| Equilibrio | 1,5-X | Exceso | x | x |
Paso 3. Se plantea la expresión matemática de la constante de hidrólisis.
NH4+ + H2O ↔ NH4OH + H+

Paso 4. Se sustituye la expresión matemática, por los valores de concentración de cada una de las especies en equilibrio, con la finalidad de hallar X, que es la fracción disociada.
**Se considera que 1,5-X = 1,5 basado en que KH tiene un valor muy pequeño.
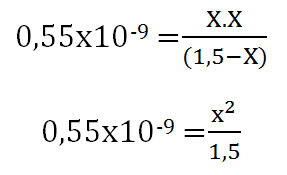
(0,55×10-9. 1,5) = X2
√8,25×10-10 = X
X= 2,87×10-5
Sustituimos el valor de X en cada una de las concentraciones de las especies:
[H+] = X = 2,87×10-5 M
[NH4OH] = X = 2,87×10-5 M
[NH4+]= 1,5-X = 1,5-2,87×10-5 M
[NH4+]= 1,49 ≈ 1,5 Molar
Paso 5.Se calcula el pH de la solución.
pH = -log [H+]
pH = -log 2,87×10-5
pH = -[log 2,87 + log 10-5]
pH = -[log 2,87 + (-5) log 10]
pH = -[0,458 -5.(1)]
pH = -0,458+5
pH = 4,54
Resuelve el siguiente ejercicio:
- Determine el pH de una solución 1,5 M de acetato de sodio, sabiendo que la constante ácida (Ka) del ácido acético es de 1,8×10-5
CH3COO– + H2O ↔ CH3COOH + OH–
REFERENCIAS
Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág.123). Fundación Editorial Salesiana.
TAMBIÉN TE PUEDE INTERESAR:

