El grupo 18 de la tabla periódica es también conocido como gases nobles.

Este término surge de la traducción del nombre alemán «edelgas», empleado por vez primera en el año 1898 por Hugo Erdmann, para señalar la baja reactividad que presenta los elementos de este grupo. Dicho calificativo es debido a una analogía con la expresión «metales nobles«, como el oro, relacionado con la fortuna y la nobleza, y que de igual manera, posee baja reactividad.

A lo largo de la historia se han utilizado varios términos para designar a los miembros de este grupo. Otro nombre es gases inertes, pero este término fue desestimado a medida que fueron estudiados más los gases y se empezaron a conocer sus características y propiedades físicas y químicas.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míPor último, el nombre gases raros también suele utilizarse, sin embargo, es erróneo puesto que el argón forma parte de la atmósfera terrestre en un 0,94 % por volumen – 1,3 % por masa.
El grupo 18 está formado por los siguientes elementos: helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn) y oganesson (Og).
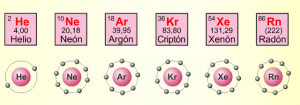
Poseen la siguiente distribución electrónica: s2p6. Por lo que todos cumplen con la regla del octeto, es decir, poseen 8 electrones en su último nivel de energía, con excepción del helio, que cumple con la regla del dueto, porque sólo tiene dos electrones y no puede tener más, puesto que su nivel de energía ya está completo para ser estable.
Propiedades físicas
- En condiciones normales, son gases monoatómicos inodoros e incoloros.
- Presentan puntos de fusión y ebullición muy bajos debido a que poseen fuerzas intermoleculares muy débiles.
- El radio atómico de los gases nobles aumenta de un periodo a otro debido al aumento en el número de electrones.
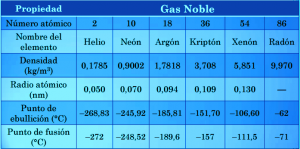
- El helio posee algunas propiedades diferentes a sus compañeros de grupo. Esto se evidencia en que su punto de ebullición y fusión son menores que los de cualquier otra sustancia conocida, de hecho es el único elemento conocido que presenta superfluidez, es decir, que carece de viscosidad.
- Los gases nobles ostentan múltiples isótopos estables, con excepción del radón que no posee. El isótopo de mayor duración tiene un periodo de semidesintegración de 3,8 días que permite formar helio y polonio.
Propiedades químicas
- Son solubles en agua.
- En condiciones estándar no son inflamables.
- Presentan átomos con capas de valencia llenas de electrones por lo que son considerablemente estables y no tienden a constituir enlaces químicos y poseen poca tendencia a ganar o perder electrones.
- El xenón reacciona de forma espontánea con el flúor, debido a la elevada electronegatividad del mismo. Se han obtenido otros compuestos a partir de la reacción de estos dos elementos.
Usos y aplicaciones de los elementos del grupo 18
Helio.
La aplicación más habitual que presenta el helio es para llenar globos, dirigibles y globos aerostáticos debido a que es más ligero que el aire.
También se puede agregar en los tanques de oxígeno de los buzos, especialmente para aquellos que bucean a grandes profundidades, por ejemplo a más de 140 metros bajo el nivel del mar.

En el campo de la medicina es utilizado en personas con asma y otras complicaciones respiratorias. Asimismo se emplea las mezclas de oxígeno y helio debido a que presenta menor densidad y mayor fluidez, proporcionando una mejor respiración.
Las cabezas de helio ionizado son empleadas en cirugía para tratar tumores en los ojos y en la reducción del flujo sanguíneo en personas con anomalías cerebrales.
Otro uso que presenta el helio es en la elaboración de combustible para cohetes, ya que permite condensar el hidrógeno y el oxígeno para su obtención.
En los laboratorios se emplea como gas portador en cromatografía de gases. También como gas protector por su carácter no reactivo, para la elaboración de cristales de silicio, germanio y para la fabricación de titanio y zirconio.
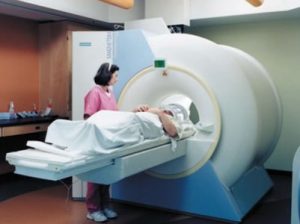
Igualmente es utilizado para enfriar los imanes superconductores en los escáneres usados en resonancias magnéticas.
El helio mezclado con el neón es usado para fabricar los láseres empleados para leer los códigos de barras.

Este gas habitualmente utilizado para percibir fugas en dispositivos de vacío y alta presión.
Neón.
El neón es usado frecuentemente en los avisos con publicidad debido a que origina una coloración bastante brillante de color naranja rojizo. Al igual que el neón, otros gases nobles también producen colores radiantes utilizados para el mismo fin, y son erróneamente llamados luces de neón.

Es empleado en la elaboración de láseres mezclado con el helio para la fabricación de dispositivos lectores de códigos de barra.
En medicina es usado el neón líquido como un refrigerante criogénico donde no se necesita de temperaturas elevadamente bajas. También se suele emplear el helio, porque es más económico pero el neón es más efectivo y viable.
Entre otros usos tenemos que se emplea en la fabricación de tubos de vacío, indicadores de alta tensión, dispositivos que resguardan los aparatos eléctricos de los rayos, tubos de ondas de medición, tubos de televisión y contadores Geiger.

Argón.
El argón es usado en los laboratorios científicos como gas portador en cromatografía de gases. Además es empleado para obtener cristales de silicio y germanio. Por su parte, en su forma líquido es utilizado por científicos para investigar la materia oscura.

En medicina se emplea el argón licuado para destruir las células cancerígenas, aunque el proceso no se lleva a cabo con mucha frecuencia debido a que existen ciertos riesgos. Asimismo, en cirugía se utiliza los láseres azules de argón para soldar las arterias y corregir complicaciones oculares.
Entre otros usos del argón tenemos que se utiliza para rellenar las lámparas o bombillos y así para impedir que el filamento reaccione con el aire y se consuma.

Igualmente se emplea para evitar la combustión del grafito en los quemadores eléctricos
También se usa como conservante de pintura, barniz y otros tintes cuando se desea almacenar luego de que estas estén abiertas
El argón es utilizado por los buzos para inflar los trajes secos.

Kriptón.
El kriptón se utiliza para fabricar bombillas incandescentes ya se solo o mezclado con argón y neón, emitiendo un brillante color anaranjado rojizo, ideal para ser usado para iluminar en pistas de aterrizaje debido a que el color rojo es divisado a largas distancias.

Otro uso de estas bombillas es en la fotografía ya que bajo ciertas condiciones se puede obtener una luz blanca ideal para los flashes fotográficos de alta velocidad.

Estas bombillas de color blanco también se emplean para fabricar tubos de gas de colores para formar un efecto parecido a los letreros de neón.
Este, igualmente, es usado en elaboración de lámparas fluorescentes, aunque este tipo de lámparas suelen ser mucho más costosas y reduce la emisión de luz. Asimismo es empleado mezclado con xenón para obtener bombillos que permiten disminuir la fundición del filamento y así poder utilizarse a temperaturas más altas.

A través de este gas se puede obtener un láser de fluoruro de kriptón, que se emplea por científicos en la investigación de la fusión nuclear. Este tipo de láser es usado comúnmente en shows de láser de alta potencia.
En medicina es usado los isótopos del kriptón en investigaciones relacionados con las vías respiratorias.
Xenón.
El xenón al igual que el kriptón es usado en fotografía ya que genera una luz blanca en ciertas condiciones que es propicio para los flashes de cámaras fotográficas.

Igualmente se utiliza para fabricar lámparas estroboscópicas, proyectores de cine y tubos de descarga.

Este gas también es usado en aparatos para llevar a cabo procesos en las plantas nucleares.
Radón.
Al ser un elemento radiactivo, los científicos han tratado por años buscarle alguna aplicación del tipo médica, por lo cual se han hecho numerosos estudios para ser empleado en el tratamiento de ciertas enfermedades como el cáncer. El proceso que por ahora se ha podido llevar a cabo, consiste de un tubo llamado semilla de radón, fabricado de vidrio o de oro, donde se coloca el gas para luego ser introducido en el tejido dañado.

Ahora bien no es un método común y muchos médicos aún desestiman que sea empleado el radón con motivos terapéuticos.
Oganesson.
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades y conocerse muy poco sobre ellos, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.


