La fracción molar relaciona el número de mol de soluto con el número de mol total presente en solución. Se designa con la letra X y no presenta unidades.
Matemáticamente se expresa de la siguiente manera:
X = X soluto + X solvente = 1
X = Fracción molar
X soluto (Xsto) = Fracción molar del soluto
X solvente (Xste) = Fracción molar del solvente
La suma de las fracciones molares del soluto y solvente es igual a 1
Otras fórmulas que nos permitirán para hallar fracción molar:

Ejercicios Resueltos
- Se disuelven 40 gramos de etanol en 60 gramos de agua. Calcule la fracción molar de la solución.
Datos:
X = ?
masa soluto = 40 gramos (etanol)
masa solvente = 60 gramos (agua)
Masa molar Etanol = 46 g/mol
Masa molar Agua = 18 g/mol
Paso # 1: Se calcula el mol de soluto y mol de solvente

Paso # 2: Hallamos el mol total
Mol total = mol soluto + mol solvente
Mol total = 0,869 mol + 3,33 mol
Mol total = 4, 12 mol
Paso # 3: Calculamos la fracción molar de soluto y solvente

Paso # 4. Finalmente calculamos la fracción molar de la solución
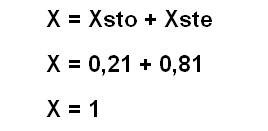
**NOTA** El resultado específico es 1,02 (por las aproximaciones que se realizaron a lo largo del ejercicio) pero como la fracción molar ha de ser igual a la unidad; se desprecia por aproximación los dos números después de la coma y se toma el valor de 1.

