
Las bases y ácidos fuertes son aquellos que al disolverse en agua se disocian en su totalidad, por ejemplo tenemos las bases hidróxido de sodio (NaOH) y el hidróxido de potasio (KOH). Los ácidos fuertes más conocidos, tenemos el ácido fluorhídrico (HF), el ácido nítrico (HNO3) y el ácido clorhídrico (HCl).
Por ejemplo, tenemos la disociación del ácido clorhídrico y del hidróxido de potasio. La concentración de los iones originados durante la disociación pertenece a la concentración inicial del soluto, debido a que todas las moléculas pasaron a la forma iónica.
HCl → H+ + Cl–
KOH → OH– + K+
Si se colocaron 0,5 mol de ácido o de la base, instantes después los tendremos en forma iónica. Habrá cero moléculas y 0,5 mol de cada uno de los iones.
Existen algunas sustancias químicas que presentan disociación incompleta, ya que poseen una acidez y basicidad bastante débil, por lo tanto, los iones y moléculas se mantienen en equilibrio, sin disociar.
En conclusión, se puede definir al equilibrio iónico, como el estado en el cual coexisten moléculas y sus iones y puede ser aplicada la ley de equilibrio químico:
Base débil: NH3 (amoniaco)
NH3 + H2O ↔ NH4+ + OH–
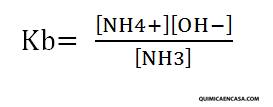
Ácido débil: CH3COOH (ácido acético)
CH3COOH + H2O ↔ CH3COO– + H3O+
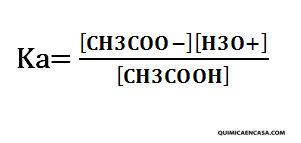
El valor de la constante de disociación permite hacer una comparación de la fuerza ácida o básica de un compuesto. Mientras mayor sea esta constante, mayor grado de disociación y, por consiguiente, mayor carácter ácido o básico.
Debido a que los valores tan pequeños de la gran mayoría de las constantes, para facilitar la comparación, se utiliza el pKa y el pKb, que se definen como:
pKa = -log Ka
pKb= -log Kb
Por ejemplo, tenemos la disociación del ácido fórmico (HCOOH):
HCOOH + H2O ↔ HCOO– + H3O+
Presenta un Ka= 1,8×10-4 por lo tanto, sustituyendo en la fórmula, queda:
pKa = -log (1,8×10-4)
pka= 3,75
EJERCICIO RESUELTO
- Se necesita saber las concentraciones en equilibrio de las especies químicas presentes en la disociación del ácido hipocloroso (HClO), conociendo que la constante Ka es 3,0×10-8 y que se colocó 2 mol de HClO en un recipiente de 1 litro.
HClO + H2O ↔ H3O+ + ClO–
- Primero se debe plantear la expresión de la constante ácida:

- Ahora se interpreta las variaciones de concentración de las diferentes especies químicas a lo largo del tiempo:
| HClO | H2O | H3O+ | ClO– | |
| Inicio | 2 Molar | Exceso | 0 | 0 |
| Equilibrio | 2-X | Exceso | X | X |
*X es la parte disociada
- El último paso, es la sustitución en la expresión de la constante de las concentraciones, para hallar el valor de X.
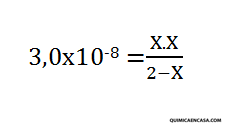
*Debido a que el Ka del HClO presenta un valor bastante pequeño, se puede suponer que X posee un valor muy pequeño, y por lo tanto, se puede hacer la siguiente aproximación: 2-X=2.

(3,0×10-8. 2) = X2
√6,0×10-8 = X
X= 2,45 x10-4
- Finalmente sustituimos el valor de X en cada una de las concentraciones de las especies:
[H3O+] = X = 2,45 x10-4 Molar
[ClO–] = X = 2,45 x10-4 Molar
[HClO] = 2-X = 2-2,45 x10-4
[HClO] = 1,9997 ≈ 2 Molar
REFERENCIAS
- Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág.119). Fundación Editorial Salesiana.

