En algunas reacciones químicas, los alcoholes primarios reaccionan mucho más rápidamente que los alcoholes secundarios y terciarios. En otras ocasiones sucede lo contrario. Estas diferencias en las velocidades de reacción se explican en gran parte cuando se consideran las fórmulas electrónicas de los alcoholes. Hay tres tipos de estructura que pueden representarse mediante los ejemplos siguientes:
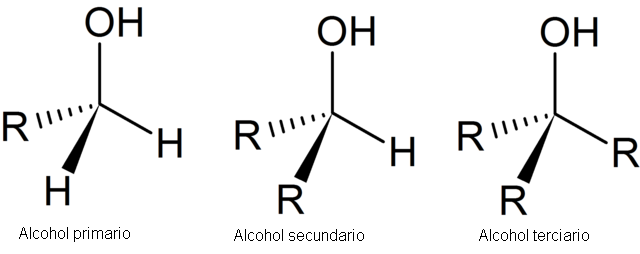
El átomo de oxigeno es fuertemente electronegativo y tiende a retirar los pares electrónicos del grupo CH3 y del átomo de H. En consecuencia, el átomo de H pierde su interés en el par electrónico del enlace O: H y se convierte en un ion. La ionización de un alcohol puede representarse como un proceso de descomposición del ROH para dar el ion RO– y el ion H+.
A continuación veremos algunas reacciones que nos permiten diferenciar los alcoholes.
-
Ensayo de Lucas.
Una manera práctica para diferenciar los alcoholes es mediante el reactivo de Lucas, que consiste en una solución de ZnCl2 (cloruro de zinc) en HCl concentrado. Con este reactivo, los alcoholes primarios se disuelven con dificultad y no forman el cloruro de alquilo a menos que se caliente o se deje la solución por varias horas.
Los alcoholes secundarios se disuelven más lentamente y se separan dos capas. Por su parte, los alcoholes terciarios reaccionan rápidamente, separándose una capa superior de cloruro de alquilo.
-
Diferenciación de alcoholes mediante la oxidación
Para diferenciar si un alcohol es primario, secundario o terciario, se recurre con frecuencia a su comportamiento frente a los oxidantes, como por ejemplo una mezcla crómica K2Cr2O7 más ácido sulfúrico.
La mayoría de los alcoholes se oxidan con facilidad, pero el transcurso de la reacción depende de la posición del grupo –OH en la molécula.
Alcoholes primarios
Estos se oxidan primeramente generando un aldehído, luego este, por oxidación posterior, produce un ácido carboxílico. Por ejemplo, la oxidación del etanol produce etanal y finalmente ácido acético. Se puede observar que los tres compuestos contiene la misma cantidad de átomos de carbono.
CH3-CH2OH → CH3-CHO → CH3-COOH
Alcoholes secundarios
Mediante la oxidación, los alcoholes secundarios producen cetonas, con el mismo número de átomos de carbono que el alcohol original. Las cetonas son muy difíciles de oxidar, sin embargo mediante acción prolongada de los agentes oxidantes origina una mezcla de ácidos, cada uno de los cuales contiene menos átomos de carbono que el alcohol original. Por ejemplo, la oxidación del alcohol secpentílico produce a la 2-pentanona y finalmente la oxidación de esta cetona genera el ácido acético y el ácido propiónico.
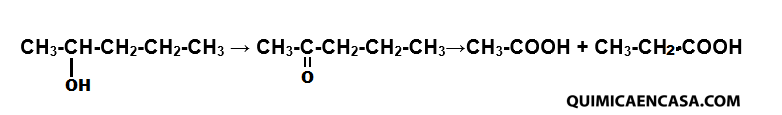
Alcoholes terciarios
Los alcoholes terciarios no se oxidan en solución alcalina o neutra, no obstante en soluciones ácidas fuertes son oxidados, rompiendo la cadena y formando una mezcla de diversos ácidos y cetonas difíciles de predecir. En los alcoholes terciarios no hay un grupo H-C-OH y, por consiguiente, se llega a la conclusión de que los alcoholes terciarios se oxidan por un mecanismo diferente.
La ecuación de óxido-reducción con el dicromato potásico es:
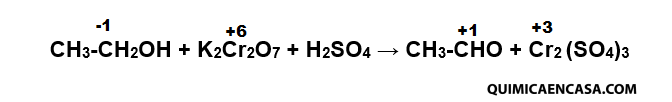
Al oxidarse el alcohol etílico a acetaldehído, el número de valencia de uno de los átomos de carbono aumenta en +2, y la disminución del número de valencia total del cromo en el dicromato potásico al pasar a sulfato crómico es de 6. Es evidente que una molécula de dicromato podrá oxidar a tres de alcohol y se formarán, a su vez, una molécula de sulfato crómico y una de sulfato potásico.
La ecuación igualada queda:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3CHO + Cr2 (SO4)3 + K2SO4 + 7H2O
Fuente
- Dr. H. Moreno González. (1983). Química Orgánica. (pág.213). Ediciones CO-BO

