
Cuando nos sirven un vaso de jugo de naranja y este está muy concentrado, por lo general si no nos gusta así, lo que hacemos de forma automática es añadir más agua, de manera tal que el sabor del jugo sea de nuestro agrado, es decir, le bajamos la concentración a la bebida. Esta técnica que ejecutamos de manera instintiva, se le llama dilución.
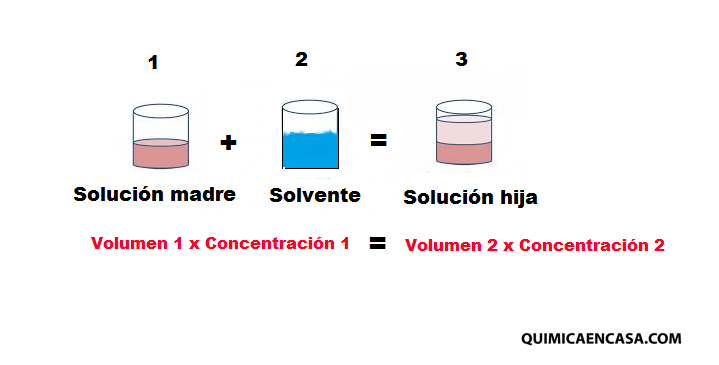
La dilución es el proceso de preparación de una solución de menor concentración a partir de otra de mayor concentración, agregando solvente. En las disoluciones, la cantidad de soluto no varia, lo que cambia es el volumen de solvente, ya que a medida que se añade más solvente, la cantidad de soluto disminuye, debido a que el volumen y masa de la solución aumenta.
Este proceso es utilizado frecuentemente en todos los ambientes, en las industrias, laboratorios y en el hogar. El proceso se lleva a cabo de la siguiente manera: al tomar una porción de la solución original, que llamaremos solución madre, de cierta concentración, se separa una pequeña cantidad de soluto del resto que se encuentra disuelto; al añadir solvente se le proporciona un espacio mayor para su dispersión. Esto se traduce en una disminución de la cantidad de soluto por unidad de volumen, originando una solución denominada «hija», de menor concentración.
La cantidad de soluto que se encuentra en la porción extraída de la solución madre se mantiene en su totalidad en la solución hija, a pesar de su mayor grado de dispersión. La expresión matemática es:
V1xC1 = V2xC2
EJERCICIOS
- Se disuelven 50 ml de una solución 1,5 mol/L en suficiente agua hasta completar 500 ml de solución. Calcule la concentración en mol/l de la solución resultante.
DATOS
Volumen 1= 50 ml
Concentración 1 = 1,5 mol/l
Volumen 2 = 500 ml
V1xC1 = V2xC2 Despejamos la concentración 2 (C2), quedando:
C2= (V1xC1) ÷ V2
Ahora sustituimos los valores que distribuimos en los datos:
C2 = (50ml x 1,5 mol/l) ÷ 500ml
C2 = 75 ÷ 500ml
C2 = 0,15 mol/l
La concentración resultante es menor a la concentración inicial, debido a que se llevo a cabo una dilución.
2. Conociendo que la densidad del H2SO4 es de 1,19 g/ml y su % de pureza es 81%. Preparar 100 ml de ácido sulfúrico 0,45 mol/l.
datos
ρ = 1,19 g/ml
%P = 81%
C2= 0,45 mol/l
V1=?
V2= 100 ml
Masa molar H2SO4= 98 g/mol
Primer paso. Hallar los gramos impuros utilizando la densidad del h2so4
1, 19 g ———– 1 ml
X ————- 1000 ml
X = 1190 g impuros
segundo paso. calcular los gramos puros a través de los gramos impuros Y EL %P
1190 g impuros ———— 100%
X ————————— 81%
X = 963,9 g puros
tercer paso. determinar la concentración 1 relacionando la masa molar del H2SO4 y los gramos puros
1 molar ———— 98 g
X ——————- 963,9 g
X = 9,84 molar (mol/l)
cuarto paso. preparar la solución determinando el volumen 1
C1 x V1 = C2 xV2
V1 = (C2 xV2) ÷ C1
Ahora sustituimos los valores:
V1 = (0,45 mol/l x 100 ml) ÷ 9,84 mol/l
V1 = 4,57 ml

