Las sustancias que presentan carbono trivalente , es decir que poseen tres enlaces, son clasificadas en relación a su carga, que depende del número de electrones no compartidos. Los carbocationes o como también son llamados, iones carbonio no poseen electrones no compartidos y tienen una carga positiva. Por su parte, los radicales libres tienen un electrón no compartido y son neutros. Los carbaniones poseen un par de electrones no compartidos y tienen una carga negativa. Ahora bien, los intermediarios más frecuentes que tienen un carbono divalente y dos enlaces son los llamados carbenos. Estos tienen dos electrones no compartidos en el átomo de carbono divalente, haciéndolo neutro, es decir, sin carga.
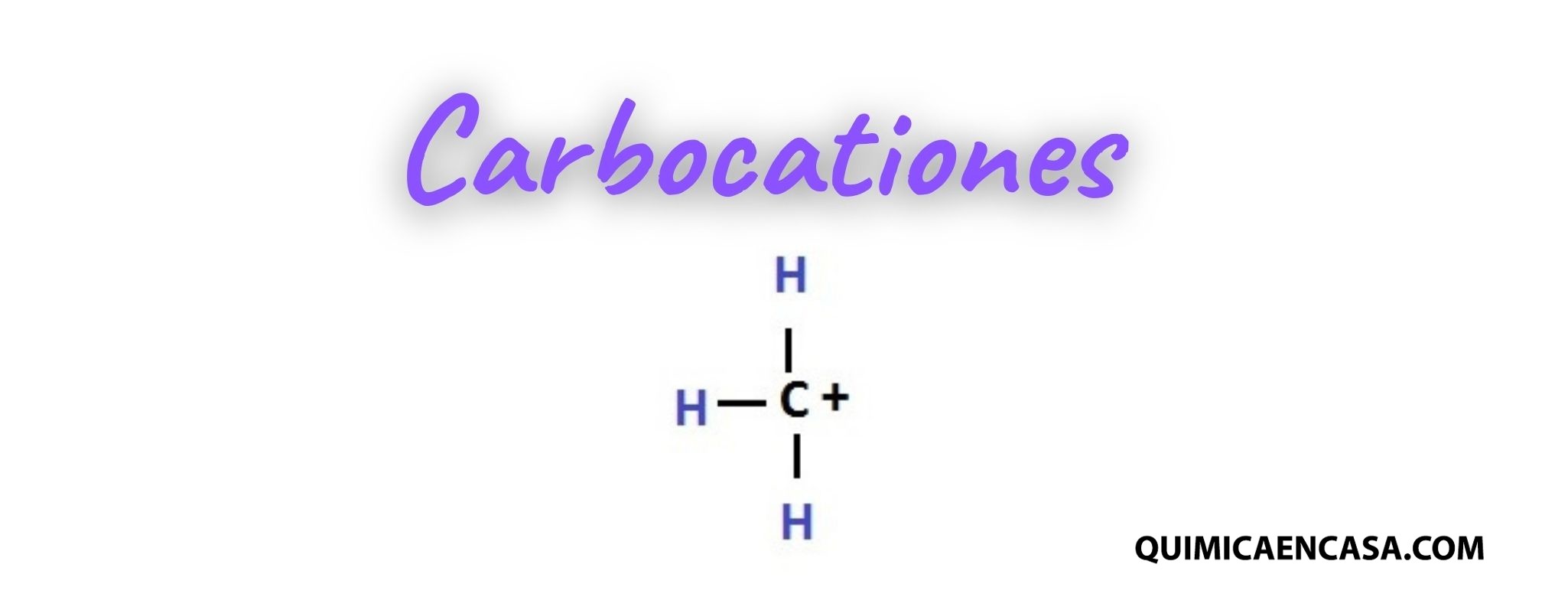
Entonces, vamos a lo que nos interesa, los carbocationes. Estas especies son llamadas también como ion carbonio y son aquellas que tienen un átomo de carbono con carga positiva; y además se encuentra enlazado a otros tres átomos y no posee electrones no compartidos. Los carbocationes presentan una hibridación sp² y una estructura plana con ángulos de 120º. Un ejemplo sería el catión metilo de fórmula CH3+. Esta especie es plana y posee ángulos de 120º. El orbital p no hibridado se encuentra vacío y queda perpendicular al plano de los enlaces C-H. La estructura del CH3+ es muy parecida a la estructura del BH3.

Una mirada cercana a los carbocationes
Los carbocationes presentan un átomo de carbono con seis electrones en su capa de valencia, y la carga positiva aumenta su reactividad hacia los nucleófilos.
Los nucleófilos son especies químicas, consideradas bases de Lewis, que reaccionan para formar un nuevo enlace covalente, cediendo un par de electrones libres a otra especie llamada electrófilos.
Por tanto, un carbocatión es particularmente un electrófilo fuerte. La mayor parte de los carbocationes reaccionan con el primer nucleófilo que encuentren, que con frecuencia es una molécula de solvente.
Relación entre los carbocationes y los radicales libres
Al igual que los radicales libres, los carbocationes son especies con deficiencia de electrones ya que poseen menos de 8 electrones en la capa de valencia del átomo de carbono. Igualmente, ambos ( radicales libres y carbocationes) se estabilizan gracias a los sustituyentes alquilos. De hecho, existe dos formas por la cual son estabilizados:
1- A través del efecto inductivo
2- Mediante el traslape parcial de orbitales llenos con vacíos.
El efecto inductivo no es más que una donación de la densidad electrónica de los enlaces sigma de la molécula. El átomo de carbono cargado positivamente retira algo de la densidad electrónica de los grupos alquilo enlazados con él.
Los sustituyentes alquilo igualmente poseen orbitales sp³ llenos y tienen la posibilidad de ser traslapados con el orbital p vacío en el átomo de carbono que tiene carga positiva, logrando estabilizar mucho más al ion carbonio. El par de electrones que tiene el enlace sigma, se extiende de manera ligera hacia el orbital p vacío, estabilizando al átomo de carbono que está deficiente de electrones. A este tipo de traslape se le llama hiperconjugación.

Los carbocationes no saturados pueden también ser estabilizados por la estabilización por resonancia. Si un enlace pi se halla adyacente a un carbocatión, los orbitales p llenos del enlace pi se traslaparán con el orbital p vacío del carbocatión. El resultado será un ion deslocalizado con carga positiva, compartida por dos átomos. La deslocalización por resonancia es bastante efectiva para estabilizar un carbocatión.
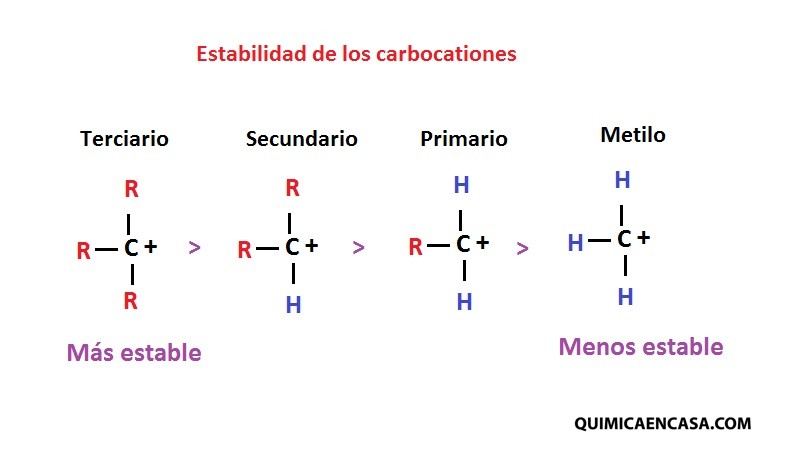
ESTABILIDAD DE LOS CARBOCATIONES
Los carbocationes más sustituidos son los más estables. Siendo así, el carbocatión terciario el más estable y el menos estable el carbocatión metilo, como se muestra a continuación:
Ejercicio
Ordene los siguientes carbocationes en orden creciente de estabilidad y además clasifique cada uno en primario, secundario o terciario, según corresponda.
- Catión isopentilo: (CH3)2-CH-CH2-CH2+
- Catión 3-metilo-2-butilo: CH3– CH+– CH-(CH3)2
- Catión 2-metilo-2-butilo: CH3-C+-(CH3)-CH2-CH3
RESPUESTA:
- Catión isopentilo: (CH3)2-CH-CH2-CH2+ PRIMARIO
- Catión 3-metilo-2-butilo: CH3– CH+– CH-(CH3)2 SECUNDARIO
- Catión 2-metilo-2-butilo: CH3-C+-(CH3)-CH2-CH3 TERCIARIO
ORDEN CRECIENTE:
Catión isopentilo < Catión 3-metilo-2-butilo < Catión 2-metilo-2-butilo

