
En este tipo de reacciones químicas, la cantidad de electrones ganados es igual a la cantidad de electrones perdidos. El número de oxidación de los elementos es crucial para determinar cuál átomo se oxidó y cuál se redujo.
El estado de oxidación o número de oxidación, es la carga que tiene un átomo cuando se contabilizan sus electrones; siguiendo reglas especificas y estrictas que fueron establecidas de forma arbitraria.
Existen dos métodos basados en los procesos de oxidación-reducción: método del número de oxidación y método del ion electrón. Para efecto de este artículo, haré referencia solo al método del número de oxidación.
Para el balanceo de las reacciones redox existen varios métodos específicos basados en los principios generales siguientes:
Conservación de la masa. Todas las especies que aparecen entre los restantes deben aparecer también entre los productos y en la misma cantidad.
Conservación de la carga. Todos los electrones cedidos por el reductor (o los reductores) deben ser ganados por el oxidante (o los oxidantes).
Términos básicos para comprender el balanceo redox
Oxidación. Es el aumento en el número de oxidación debido a la pérdida de electrones. Ejemplos:
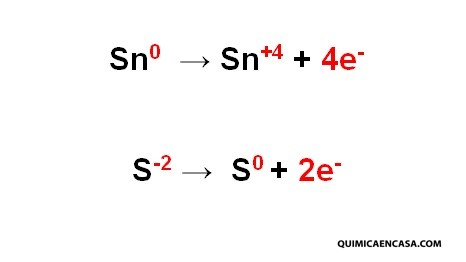 Según el ejemplo anterior, el estaño como el azufre sufren un cambio donde sus números de oxidación aumentan. En el estaño, el número de oxidación aumentó de cero a +4 por la pérdida de 4 electrones. En el azufre, el número de oxidación aumentó de -2 a cero, por la pérdida de 2 electrones.
Según el ejemplo anterior, el estaño como el azufre sufren un cambio donde sus números de oxidación aumentan. En el estaño, el número de oxidación aumentó de cero a +4 por la pérdida de 4 electrones. En el azufre, el número de oxidación aumentó de -2 a cero, por la pérdida de 2 electrones.
Reducción. Es la disminución en el número de oxidación para la ganancia de electrones. Ejemplos:
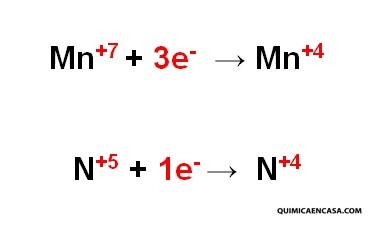
Según el ejemplo anterior, el manganeso disminuye su estado de oxidación de +7 a +4, por la ganancia de 3 electrones. Por su parte, el nitrógeno, disminuye su número de oxidación de +5 a +4 , por la ganancia de 1 electrón.
Las etapas a seguir para el balanceo son las siguientes:
- Asignar los números de oxidación a todos elementos que están inmersos en la reacción química. Para ello es importante saber calcular los números de oxidación a especies químicas. En este link te explico como se realiza: https://quimicaencasa.com/calculo-de-estados-de-oxidacion-de-los-elementos/
- Observar cuales son los átomos en los cuales cambian los estados de oxidación.
- Establecer el número de electrones transferidos para cada átomo.
- Establecer el número de electrones transferidos por unidad-fórmula.
- Compensar la pérdida y ganancia de electrones, atribuyendo coeficientes apropiados a los agentes oxidantes y reductivos
- Colocar los coeficientes de las demás fórmulas de manera que se cumpla el principio de conservación de la masa.
EJERCICIOS
Balancee las siguientes reacciones redox utilizando el método del número de oxidación.
- HBr + MnO2 → Br2 + MnBr2 + H2O
Paso 1. Se escribe el número de oxidación de cada elemento.
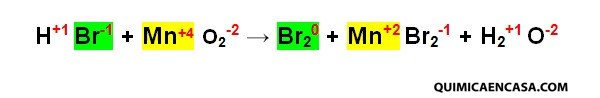
Sí observamos los estados de oxidación de cada átomo, tendremos que el bromo se oxida porque aumenta su número de oxidación. Por su parte, el manganeso se reduce ya que su número de oxidación pasa de +4 a +2.
Paso 2. Se seleccionan los elementos que han sufrido variación en el número de oxidación y se arma las semi reacciones.
Br-1 → Br20 OXIDACIÓN
Mn+4 → Mn+2 REDUCCIÓN
Como el bromo aumenta su estado de oxidación, quiere decir que se oxida.
Como el manganeso disminuye su estado de oxidación, quiere decir que se reduce.
Paso 3. Ahora es necesario balancear la masa de las sustancias inmersas en la semi reacción.
2Br-1 → Br20
Mn+4 → Mn+2
Paso 4. Se iguala la cantidad de electrones ganados con la cantidad de electrones perdidos. El número de electrones ganados se coloca en la especie que sufrió oxidación y el número de electrones perdidos en la ecuación donde se encuentra la especie química que se redujo.
2Br-1 → Br20 + 2e–
Mn+4 + 2e- → Mn+2
Paso 5. Se suman las semi reacciones

Paso 6. Hallar la ecuación molecular balanceada. Los elementos que aún no estén balanceados se ajustan por tanteo.
4HBr + MnO2 → Br2 + MnBr2 + 2H2O
2. I2 + HNO3 → HIO3 + NO2 + H2O
Paso 1. Se escribe el número de oxidación de cada elemento.
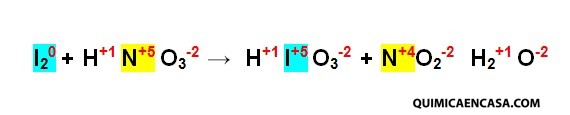
Paso 2. Se seleccionan los elementos que han sufrido variación en el número de oxidación y se arma las semi reacciones.
I20 → I+5 OXIDACIÓN
N+5 → N+4 REDUCCIÓN
Como el yodo aumenta su estado de oxidación, quiere decir que se oxida.
Como el nitrógeno disminuye su estado de oxidación, quiere decir que se reduce.
Paso 3. Ahora es necesario balancear la masa de las sustancias inmersas en la semi reacción.
I20 → 2I+5
N+5 → N+4
Paso 4. Se iguala la cantidad de electrones ganados con la cantidad de electrones perdidos. El número de electrones ganados se coloca en la especie que sufrió oxidación y el número de electrones perdidos en la ecuación donde se encuentra la especie química que se redujo.
I20 → 2I+5 + 10e–
N+5 + 1e– → N+4
Paso 5. Igualamos las cargas, multiplicando la segunda reacción por 10.
I20 → 2I+5 + 10e–
(N+5 + 1e– → N+4) * 10
quedando:
I20 → 2I+5 + 10e–
10N+5 + 10e– → 10 N+4
Paso 6. Se suman las semi reacciones.

Paso 7. Hallar la ecuación molecular balanceada. Los elementos que aún no estén balanceados se ajustan por tanteo.
I2 + 10HNO3 → 2HIO3 + 10NO2 + 4H2O
Fuente:
Caballero A y Ramos F. Química. Ciencias y Ciclo Profesional. Editorial DISCOLAR. Caracas, 2002.

