Esta nomenclatura surge ante la confusión generada por el uso de nombres comunes diferentes para las sustancias, en diferentes países de las sustancias. Por tal razón, en el año 1947 se consolidó la Unión Internacional de Química Pura y Aplicada (IUPAC, Siglas en inglés), encargada de estructurar las reglas y principios, que de manera unificada describiera los compuestos químicos.
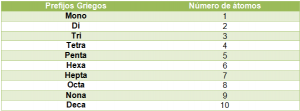
Consiste en nombrar los compuestos empleando prefijos griegos, los cuales nos indica el número de átomos presente en cada elemento involucrado en un compuesto dado.
A lo largo del tiempo la nomenclatura IUPAC ha ido cambiando y actualizando sus normas. Acá veremos las normas más antiguas a las más actuales.
Para nombrar los compuestos inorgánicos se debe seguir la siguiente fórmula general, sugerida por la IUPAC:
prefijo + nombre genérico + prefijo + nombre específico
Entonces esto me quiere decir que se debe colocar prefijos griegos antes de cada nombre genérico y específico. Pero ¿qué es un nombre genérico y un nombre específico? ¿cómo los diferencio?
Los nombres genéricos son aquellos que me indican el tipo de compuesto al cual deseo nombrar, es decir, si es un óxido, hidróxido, hidruro, entre otros. Si tengo el siguiente compuesto: CO monóxido de carbono, en este caso el nombre genérico será la palabra óxido.
Ahora bien, los nombres específicos son aquellos que me permiten identificar o diferenciar las moléculas dentro de un mismo grupo o género de compuestos. Por ejemplo: Si tenemos dos hidróxidos uno de aluminio y otro de hierro. Ambos tienen el mismo nombre genérico pero diferentes nombres específicos.
Los prefijos griegos, por su parte, son aquellas palabras que indican la atomicidad de los elementos y se colocan antes de cada nombre genérico y específico.
*Importante* En el Libro Rojo (p. 71) se puede leer:
“El prefijo “mono” es, hablando estrictamente, superfluo y se necesita solamente para enfatizar la estequiometría cuando se comentan sustancias relacionadas por la composición”.
1.- Óxidos. Los óxidos surgen de la combinación de un metal o un no metal con oxígeno.
Nomenclatura sistemática (anterior al libro rojo de la IUPAC del 2005) Recomendaciones de 1990
Estos se nombran colocando al inicio la palabra óxido luego más de metal o no metal.
Cl2O7
Lo primero que observamos es que tenemos un óxido no metálico u óxido ácido. Entonces su nombre sería óxido de cloro, pero siguiendo las reglas de la IUPAC utilizando prefijos griegos, sería:
Heptaóxido de dicloro
Nomenclatura sistemática ( libro rojo de la IUPAC del 2005)
En el Libro Rojo de las recomendaciones de 2005 de la IUPAC se puede leer (IR-1.6.3):
En la nomenclatura de Química Inorgánica, IUPAC Recomendaciones de 1990 (Ref. 11), la posición del oxígeno en ciertas secuencias de elementos fue tratada como una excepción. Estas excepciones han sido eliminadas y la secuencia de elementos de la Tabla VI es ahora estrictamente respetada. En particular, el oxígeno es tratado como el componente electropositivo con respecto a cualquier halógeno para la construcción de los nombres según el sistema en el que se indica la composición (sección IR-5.2) y las fórmulas correspondientes (Sección de IR-4.4.3) para los compuestos binarios. Esto se traduce en, por ejemplo, la fórmula OCl2 y el nombre cloruro de dioxígeno en lugar de la fórmula ClO2 y el nombre dióxido de cloro.”
La unión del oxígeno con los halógenos (F, Cl, Br, I) es una novedad importante. Ahora el oxígeno debe estar escrito en primer lugar y ser nombrado en segundo; y el halógeno debe estar escrito en segundo lugar y ser nombrado en primero. Estas sustancias serán ahora fluoruros, cloruros, bromuros o yoduros de oxígeno. Las reglas para asignar los números de oxidación no han sido modificadas, así que para una sustancia de fórmula OCl2 y nombre dicloruro de oxígeno (antes escrita Cl2O y nombre óxido de dicloro) siguen siendo (I) para el cloro y (-II) para el oxígeno.
Debido a que se han nombrado como óxidos durante mucho tiempo, se seguirán encontrando de ese modo, hasta que se vaya imponiendo la nueva recomendación.
Por ejemplo:
O5Br2 dibromuro de pentaoxígeno
2.- Ácidos
a) Hidrácidos:
Los hidrácidos surgen de la combinación de hidrógeno con un no metal que no sea oxígeno. Para nombrarlos se coloca la raíz del no metal más el sufijo uro y al final la palabra hidrógeno.
HI yoduro de hidrógeno
En este caso se debe obviar el prefijo mono.
b) Oxoácidos
Los oxoácidos provienen de la combinación de un óxido ácido más agua.
Nomenclatura sistemática (anterior al libro rojo de la IUPAC del 2005)
Para nombrarlos se coloca la raíz del nombre del no metal, más el sufijo ato, seguido del número romano correspondiente al estado de oxidación del no metal y por último la palabra hidrógeno. El oxígeno se nombra empleando la abreviatura oxo.
H2SO4 Tetraoxosulfato (VI) de hidrógeno
En la otra forma, llamada anteriormente como sistemática funcional, se antepone la palabra ácido. Después se nombran los oxígenos, mediante la palabra “oxo-”, precedida del prefijo de cantidad. A continuación, se nombra el átomo central, acabado en “-ico”, seguido por el número de oxidación entre paréntesis; si es necesario, se añade un prefijo de cantidad. Por ejemplo:
H2SO4 ácido tetraoxosulfúrico (VI)
Nomenclatura sistemática ( libro rojo de la IUPAC del 2005)
Nomenclatura de adición. Esta forma de nomenclatura da información estructural. Así, se nombra el átomo central y, utilizando los prefijos correspondientes, los grupos o ligandos que se unen a él, ordenados alfabéticamente delante del nombre del átomo central.
Lo habitual, en los oxoácidos que estudiamos, es encontrar los hidrógenos “ácidos” unidos a oxígenos y estos unidos al átomo central; y, por otro lado, se encuentran átomos de oxígeno que se unen directamente al átomo central. Es decir, al átomo central se pueden unir grupos -OH (que se nombran como “hidroxido-”) y grupos =O (que se nombran como “oxido-”), ambos precedidos por los prefijos de cantidad correspondientes. El nombre se finaliza con el nombre del átomo central. Por ejemplo:
HBrO2 hidroxidooxidobromo
Nomenclatura de hidrógeno. Para los oxoácidos y sus derivados hay una forma alternativa de nomenclatura aceptada por la IUPAC.
Consiste en nombrar, en primer lugar, los hidrógenos que contiene el ácido mediante la palabra “hidrogeno-”, precedida por el prefijo de cantidad. A continuación, sin dejar espacios y entre paréntesis, se nombra el anión según la nomenclatura de adición; es decir, en general, se nombran los oxígenos que tiene y se acaba con la raíz del nombre del átomo central acabado en “-ato”. Por ejemplo:
H2CO3 dihidrogeno(trioxidocarbonato)
3.- Hidruros
Los hidruros provienen de la combinación de un metal o no metal con hidrógeno. En este caso el hidrógeno trabaja como anión H–
Nomenclatura sistemática (anterior al libro rojo de la IUPAC del 2005)
Se nombran colocando la palabra hidruro, anteponiendo el prefijo griego que corresponda al estado de oxidación del elemento que acompaña al hidrógeno, seguido del nombre del metal o no metal que lo acompaña.
FeH3 TriHidruro de hierro
PH3 Trihidruro de fósforo
Hidruros padres o progenitores
Uno de los sistemas de nomenclatura recogidos en las recomendaciones de 2005 de la IUPAC, es la denominada sustitutiva. Esta forma de nombrar los compuestos está basada en los denominados “hidruros padres o progenitores”. Estos son hidruros, con un número determinado de átomos de hidrógeno unidos al átomo central, de los elementos de los grupos 13 al 17 de la tabla periódica.
El nombre de los hidruros padres o progenitores están recogidos en la tabla siguiente (tabla IR-6.1. de las recomendaciones de 2005 de la IUPAC):
| Grupo 13 | Grupo 14 | Grupo15 | Grupo 16 | Grupo 17 | |||||
| BH3 | Borano | CH4 | Metano | NH3 | Azano o amoníaco | H2O |
Oxidano o agua |
HF | Fluorano |
| AlH3 | Alumano | SiH4 | Silano | PH3 | Fosfano | H2S | Sulfano | HCl | Clorano |
| GaH3 | Galano | GeH4 | Germano | AsH3 | Arsano | H2Se | Secano | HBr | Bromano |
| InH3 | Indigano | SnH4 | Estanano | SbH3 | Estibano | H2Te | Telano | HI | Yodano |
| TlH3 | Talano | PbH4 | Plumbano | BiH3 | Bismutano | H2Po | Polano | HAt | Astatano |
Se admiten los nombres comunes de amoniaco para el NH3 y de agua para el H2O; pero dejan de ser aceptados los nombres comunes de fosfina (PH3), arsina (AsH3) y estibina (SbH3), que deben de ir abandonándose.
4.- Bases o Hidróxidos.
Los hidróxidos se originan de la combinación de un óxido básico más agua. Los identificamos cuando observamos en el compuesto a nombrar el ion hidroxilo: OH–
Para nombrarlos se coloca la palabra hidróxido seguido del nombre del metal que lo acompaña.
Cu (OH)2 DiHidróxido de cobre
5.- Sales
a) Sales binarias: Estas se originan de la combinación de un hidrácido más un hidróxido. Se nombran colocando la raíz del no metal, seguido del sufijo uro más el nombre del metal.
Ca F2 Difluoruro de calcio
b) Sales ternarias u oxisales: Se originan de la combinación de un oxácido con un hidróxido.
Nomenclatura sistemática (anterior al libro rojo de la IUPAC del 2005)
Primero se nombran el anión con Oxo precedidos de los prefijos griegos multiplicativos que indican el número de oxígenos presentes en la molécula unido al nombre del no metal terminado en el sufijo -ato (y con sus prefijos multiplicativos si hubiese más de un átomo central) , seguidos del número de oxidación del átomo de no metal central entre paréntesis y en números romanos, después el catión con los prefijos multiplicativos que sean necesarios. Si el anión tuviese subíndice (entre paréntesis) se puede expresar mediante los prefijos numerales multiplicativos griegos bis-, tris-, tetraquis-, pentaquis-, etc. o indicando el número de oxidación del catión en romanos y entre paréntesis al modo de Stock. Por ejemplo:
Mg SO3 Trioxosulfato (IV) de magnesio
Cuando estamos en presencia de una sal ternaria donde el ion está «rodeado» entre paréntesis por el estado de oxidación del metal, se emplea los siguientes prefijos:
Bis =2
Tris = 3
Tetrakis = 4
Pentakis =5
Hexakis = 6
Heptakis= 7
Por ejemplo, para el siguiente compuesto:
Au(NO3)3 Tris[trioxonitrato (V)] de oro (III)
Nomenclatura sistemática ( libro rojo de la IUPAC del 2005)
La IUPAC en su libro rojo del 2005 recomienda para las sales ternarias dos nomenclaturas:
- La de adición según la cual la sal se considera un compuesto binario escribiéndose el nombre del anión seguido del nombre del catión, con la carga entre paréntesis (sistema de Ewens-Bassett). Si el catión tiene un único número de oxidación no se especifica. En esencia es como la sistemática pero poniendo las cargas del anión (en lugar del número de oxidación del no metal) y el catión pero poniendo las cargas en números arábigos y con su signo y en vez de oxo para el oxígeno se pone oxido. Por ejemplo:
Pb3(PO4)4 tetraoxidofosfato (3-) de plomo (4+)
- Estequiométrica que es como la sistemática, cambiando oxo por óxido y sin indicar estados de oxidación. Por ejemplo:
Pb3(PO4)4 tetraquis[tetraóxidofosfato] de triplomo
FUENTES:
Libro Rojo de la IUPAC
http://iesbinef.educa.aragon.es/
http://acorral.es/

