
En el mundo de la química, a menudo dibujamos moléculas y damos por hecho que los electrones se reparten de forma equitativa. Sin embargo, para entender cómo reaccionan las sustancias, necesitamos llevar una «contabilidad electrónica». Aquí es donde entra la Carga Formal.
¿Qué es la Carga Formal?
La carga formal es una herramienta que usamos los químicos para saber si un átomo dentro de una molécula tiene más o menos electrones de los que debería tener en su estado natural. No es una carga real como la de un ion, sino una forma de evaluar la estabilidad de nuestras estructuras de Lewis.
La Fórmula Maestra
Para calcularla, solo necesitas esta sencilla fórmula:
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míCarga Formal = (e– de valencia) – (e– de enlace) ÷ 2 – (e– libres)
Tip para principiantes: Si no quieres dividir, simplemente cuenta los puntos (electrones libres) y las rayitas (enlaces) que tocan al átomo:
C.F. = Valencia – Rayitas – Puntos
Casos de Estudio: De la pizarra a la realidad
A continuación, analizamos dos ejemplos clave que suelen causar confusión en los exámenes:
1. El Oxicloruro de Fósforo (PCl3O)
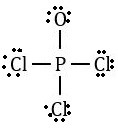
Hallar las cargas formales para el fósforo (P) y para el oxígeno (O):
Para el fósforo:
Electrones de valencia: 5
Enlaces de valencia: 8/2=4
Electrones de pares libres: 0
Carga Formal = 5-4-0
Carga Formal del fósforo = +1
Para el oxígeno:
Electrones de valencia: 6
Enlaces de valencia: 2/2 = 1
Electrones de pares libres: 6
Carga Formal = 6-1-6
Carga Formal del fósforo = -1
Si usamos un enlace doble (P=O): Al expandir el octeto del Fósforo, ambos átomos logran una carga formal de 0. Esta suele ser la estructura más estable porque minimiza las cargas.
2. El Monóxido de Carbono (CO)
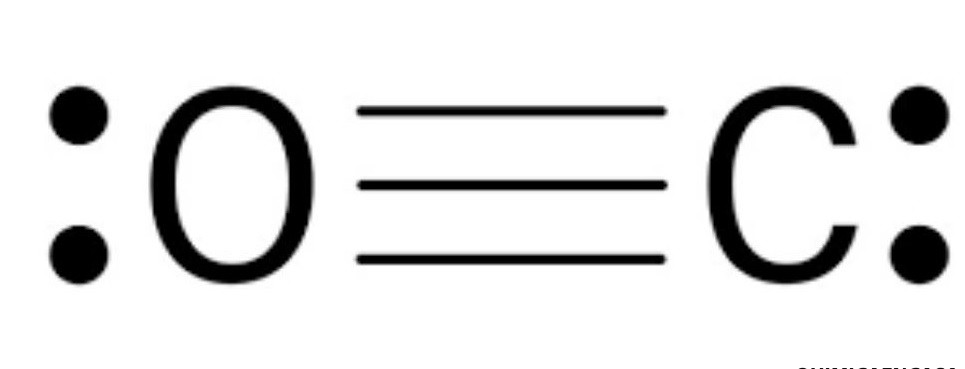
¿Sabías que en esta molécula el Oxígeno tiene carga positiva? Aunque el Oxígeno es más electronegativo, para que ambos átomos completen su octeto necesitan un triple enlace.
- Carbono: 4 – 3 – 2 = -1
- Oxígeno: 6 – 3 – 2 = +1
Es un recordatorio de que la carga formal es un modelo matemático y no siempre sigue la intuición de la electronegatividad.
Diferencia Vital: Carga Formal vs. Polaridad (δ)
Es común confundir estos términos. Mientras que la Carga Formal es un número entero (+1, 0, -1), la Polaridad se representa con la letra griega delta minúscula (δ).
Por ejemplo, en el H-Cl:
- La carga formal de ambos es 0.
- Pero en la realidad, el Cloro es δ- (atrae más los electrones) y el Hidrógeno es δ+.
La carga formal nos dice si la estructura de Lewis es «correcta», mientras que el δ nos dice hacia dónde se mueven los electrones de verdad.
Entender las cargas formales es como conocer el rol de cada integrante en una coreografía: aunque todos se mueven (resonancia), el equilibrio total es lo que hace que la presentación (molécula) sea perfecta.
¿Te ha servido esta guía? ¡Déjame tus dudas en los comentarios!

