La afinidad electrónica es la medida de la variación energética que se produce al introducir un electrón en la última capa de un átomo. También se le define como la energía que libera un átomo gaseoso cuando se encuentra en su estado fundamental y capta un electrón libre, transformándose así en un ion mononegativo.
La afinidad electrónica aumenta en la medida que la capa en la cual se introduce es más pequeña o de menor contenido energético.
Mientras más positiva sea la afinidad electrónica de un elemento, mayor la afinidad de un átomo de dicho elemento para admitir un electrón. Desde otra perspectiva, se puede señalar que la afinidad electrónica es considerarla como la energía que se debe suministrar para desprender un electrón de un anión.
Por ejemplo, se tiene el caso del flúor:
F– (g) → F (g) + e– ΔH = +328 KJ/mol
Por tal razón, el flúor es el elemento de la tabla periódica que obtiene un electrón más con mayor facilidad.
La afinidad electrónica es positiva si la reacción es exotérmica y es negativa si la reacción es endotérmica.
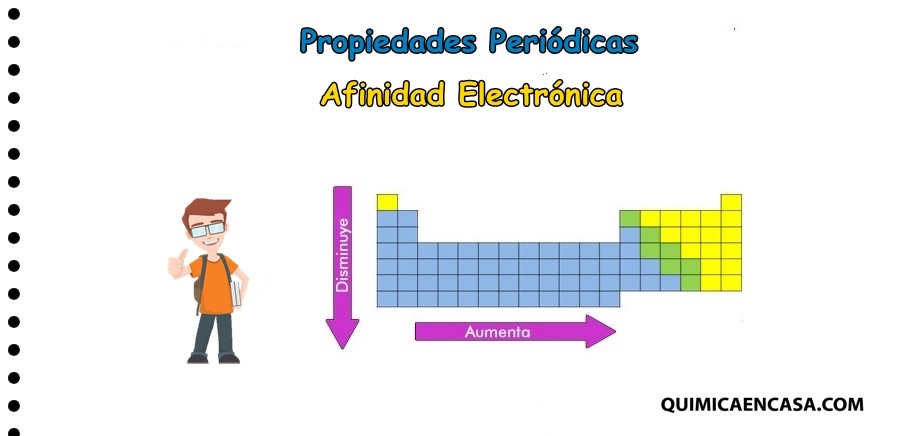
tendencia en la tabla periódica
No obstante, a pesar de que la afinidad electrónica muestra un comportamiento irregular y desorganizado, también se pueden visualizar ciertos estándares fijos. Por ejemplo, los elementos metálicos poseen afinidades electrónicas mayores que los no metales, con excepción de los gases nobles cuyos valores son positivos debido a la estabilidad química que presentan, puesto que la regla del octeto influye directamente en las afinidades electrónicas de elementos.
Por su parte, los elementos que forman parte del grupo 1: metales alcalinos (litio, sodio, potasio, rubidio, cesio y francio), poseen la capacidad de ganar un electrón y crear aniones -1, logrando completar el subnivel s. No obstante, los elementos del grupo 2: los alcalinotérreos (berilio, magnesio, calcio, estroncio, bario y radio), estos poseen el subnivel s completo y por tal razón, no muestran dicha tendencia.
De manera semejante ocurre en el bloque p, donde se puede observar que las afinidades electrónicas se hacen cada vez más negativas de izquierda a derecha.
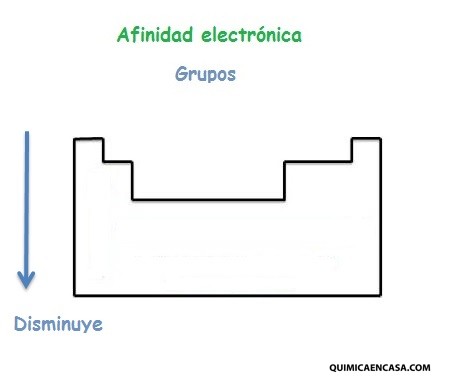
Afinidad electrónica en los grupos de la tabla periódica
La afinidad electrónica disminuye en la medida que se baja en tabla periódica, considerando los elementos del mismo grupo.
Afinidad electrónica en los periodos de la tabla periódica
Esta aumenta de izquierda a derecha en un mismo periodo.

FUENTE:
- Chang, Raymond. (2013) Química. 11va Edición.
- Rodríguez, María del Pilar. (2006). Química. Editorial Salesiana.

