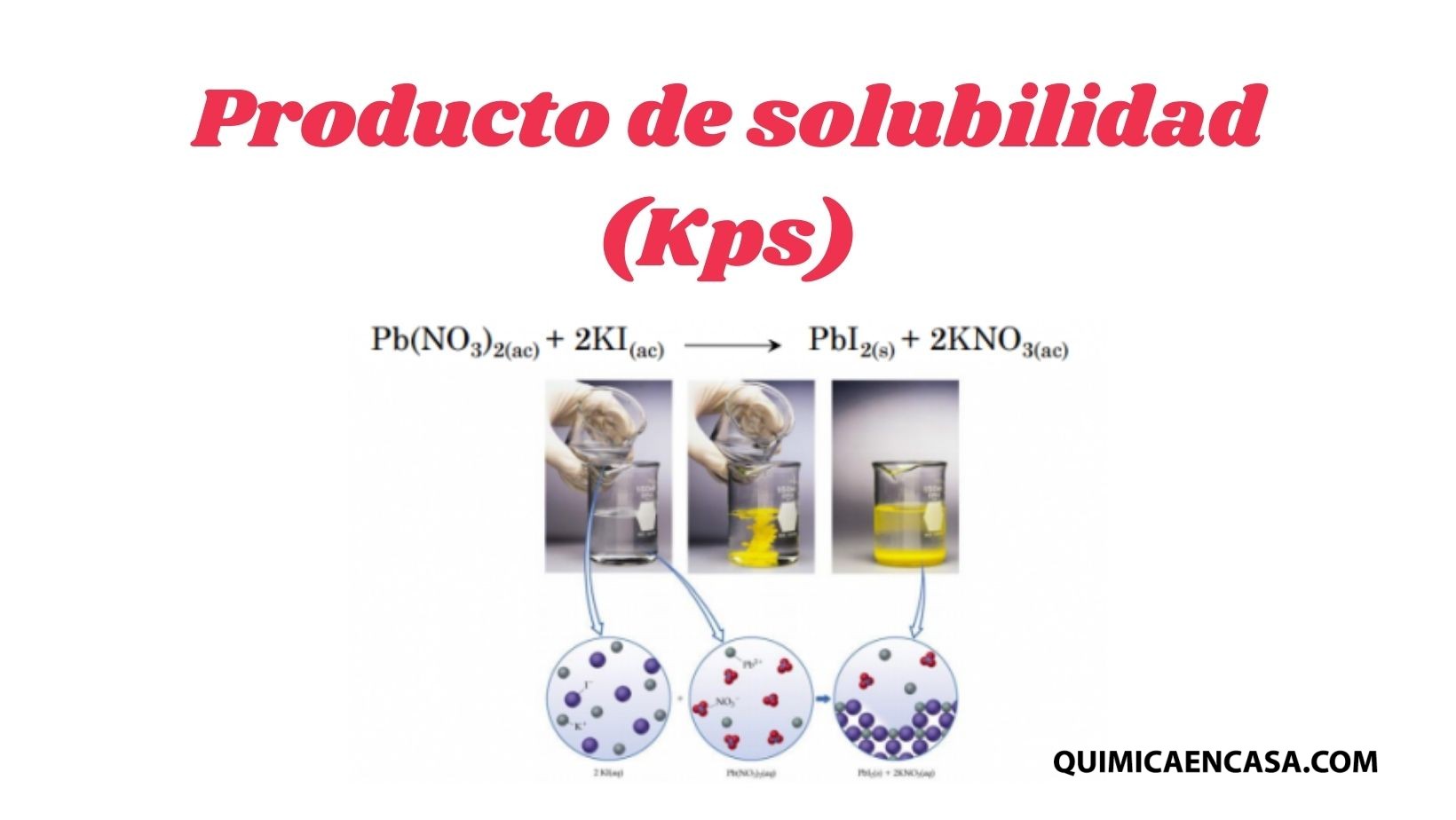
El producto de solubilidad representando por Kps es una constante dependiente de la temperatura, que representa las concentraciones de los iones presentes en una solución, en equilibrio con el soluto no disuelto.
Se utiliza en aquellos casos en el cual el soluto iónico presenta poca solubilidad en agua, y se puede decir que representa la cantidad máxima de iones que se pueden mantener en solución; por lo tanto, cualquier intento por aumentarlo o precipitarlo debe considerar esta constante y la temperatura de trabajo.
Por ejemplo, se presenta un sistema que responde a esta reacción química:
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míAB ↔ A+ + B–
Siendo AB la parte del soluto que se mantiene sin disolverse, el producto de las concentraciones de los iones A+ y B– en una solución saturada será igual al Kps. Si el número de iones formados es mayor, la expresión quedaría:
A2B3 ↔ 2A+3 + 3B-2 Ki = [A+3]2 [B-2]3
En una solución saturada el producto de las concentraciones de los iones A+3 y B-2 elevada a sus respectivos coeficientes, será igual al Kps.
Kps > Ki: Si el Kps es mayor, la solución es diluida, tiene capacidad para disolver más soluto.
Kps = Ki: La solución está saturada, tiene la máxima cantidad de iones en solución que puede contener.
Kps < Ki: La solución se encuentra sobresaturada, tiene más iones en solución de los que puede contener; por lo tanto, precipitarán en forma sólida la cantidad que se encuentre en exceso.
Ejercicio
La solubilidad para el CaF2 (Fluoruro de calcio) a la temperatura de 25ºC es de 2,1×10-4 mol/litro. Calcule el producto de solubilidad (Kps).
CaF2 ↔ Ca+2 + 2F–
Por cada mol de CaF2 que se disuelven se produce 1 mol de iones de calcio y 2 moles de iones fluoruro (F–).
Por lo tanto:
[Ca+2]= 2,1 x10-4 Molar
[F–]= 2(2,1 x10-4) Molar
Kps = [Ca+2] [F–]2
Kps = (2,1×10-4) (4,2×10-4)2
Kps = 3,7 x10-11
FUENTE
Rodríguez, María del Pilar. (2006). Química 1. (Segunda edición., pág. 129). Fundación Editorial Salesiana.

