La ley de las proporciones múltiples, señala que cuando dos elementos se unen formando dos o más sustancias compuestas, la masa de un elemento permanece fijo, mientras que la masa del otro elemento varía en una relación de número enteros sencillos.

Esta ley fue formulada en 1803 por John Dalton, y es una de las leyes más básicas de la química. Fue demostrada por el químico y físico francés Louis Joseph Gay-Lussac.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí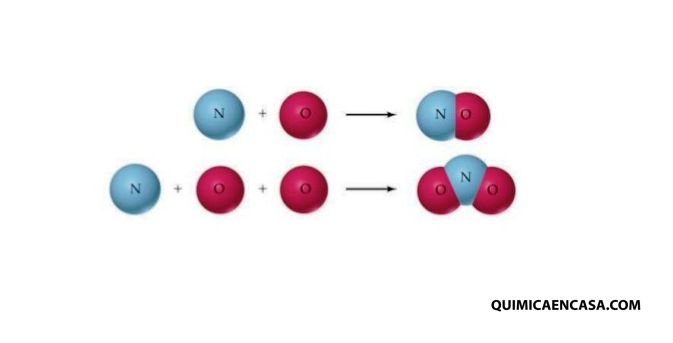
Ejemplos
- Se conoce dos óxidos de cobre posibles; en uno de ellos 1g de oxígeno se combina con 3,96g de cobre y en el otro, 1g de oxígeno está unido a 7,92g de cobre. ¿En qué proporción están entre sí las diferentes cantidades de cobre que se unen entre sí?
Las cantidades de cobre que se unen con una misma cantidad de oxígeno, están entre sí en la relación de 3,96:7,92. Dividiendo ambos números entre el menor para simplificar la proporción:
3,96÷3,96 = 1
7,92÷3,96 = 2
Entonces, las cantidades de cobre están en la relación numérica sencilla de 1:2.
- El carbono forma dos compuestos con el oxígeno; en uno, 12g de carbono se combinan con 16 g de oxígeno y en el otro , 12g de carbono se unen con 32g de oxígeno. ¿En qué proporción están las cantidades variables de oxígeno?
16÷16= 1
32÷16=2
Las cantidades de oxígeno están en la relación numérica sencilla de 1:2.

