La ley de Gay-Lusacc es una de las leyes de los gases. Esta establece que la presión de un volumen fijo de un gas, es directamente proporcional a su temperatura.
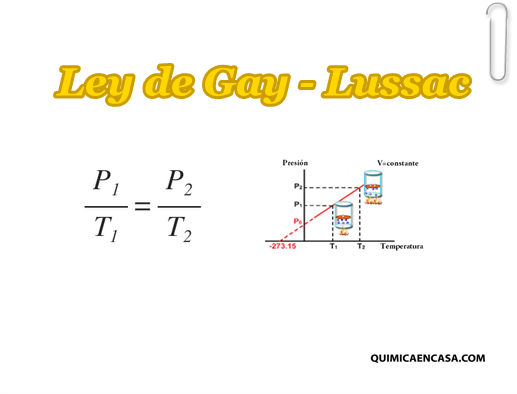
Joseph-Louis Gay-Lussac, fue un químico y físico francés, conocido por su contribución a las leyes de los gases. Para el año 1802, fue el primer científico en formular la ley según la cual un gas se expande proporcionalmente a su temperatura (kelvin) si se mantiene constante la presión y que aumenta proporcionalmente su presión si el volumen se mantiene constante.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí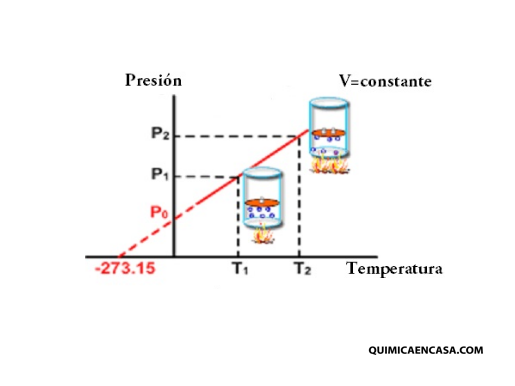
Entonces, Si el volumen de una cierta cantidad de gas ideal a una presión moderada se mantiene constante, el cociente entre presión y temperatura permanece constante:
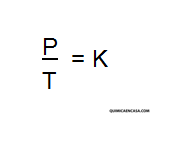
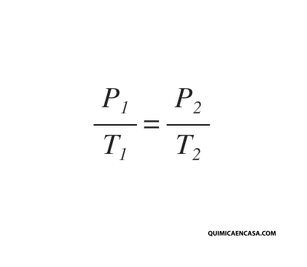
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Ejemplo
- Una cierta cantidad de gas se encuentra a la presión de 960 mm Hg cuando la temperatura es de 34 ºC. Calcula la presión (en la unidad de atmósfera) que alcanzará si la temperatura sube hasta los 195ºC.
Como el volumen y la masa permanecen constantes en el proceso, podemos aplicar la ley
de Gay-Lussac:
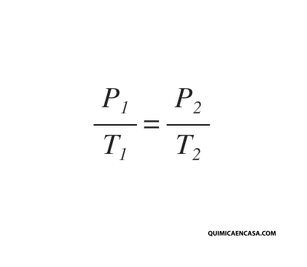
Que también se puede expresar como: P1. T2 = T1. P2
Datos:
P1 = 960 mmHg
T1 = 34 °C + 273 = 307 K
T2 = 195 °C + 273 = 478 K
P2 = ?
Entonces despejamos P2 en la fórmula: P2 = P1.T2 / T1
Ahora sustituimos:
P2 = 960 mmHg x 478 K ÷ 307 K
P2 = 1494,72 mmHg
Finalmente transformamos el valor de la presión obtenida de mmHg a atm:
1 atm ———— 760 mmHg
x —————– 1494,72 mmHg
X = 1,97 atmósfera

