Robert Boyle fue un filósofo natural, químico, físico, inventor y teólogo cristiano. Además es considerado como el primer químico moderno y por consiguiente, uno de los fundadores de la química moderna y por formular la ley de Boyle.
Por su parte, Edme Mariotte fue un abad, físico y químico francés. Estudió la compresión de los gases y llegó a descubrir la ley hoy conocida como ley de Boyle-Mariotte.
Ambos científicos (Boyle y Mariotte), de forma independiente, llegaron a la misma ley. Cabe destacar que Boyle en sus escritos no especificó que la temperatura debía ser constante para que la ley fuese válida; probablemente realizó sus experimentos y lo daría por hecho. No obstante, Mariotte si especificó esta constancia
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míEsta ley es una simplificación de la Ley de los gases ideales, utilizada para procesos isotérmicos de una cierta masa de gas constante.
Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle-Mariotte forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ley de los gases ideales.
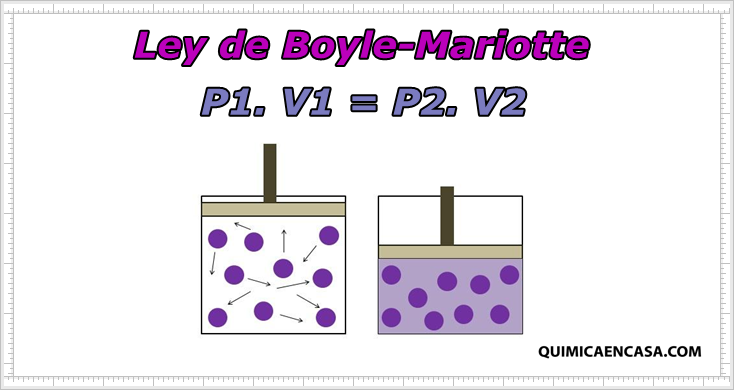
La ley de Boyle-Mariotte señala lo siguiente:
A temperatura constante, los volúmenes ocupados por una masa gaseosa son inversamente proporcionales a las presiones a que son sometidos.
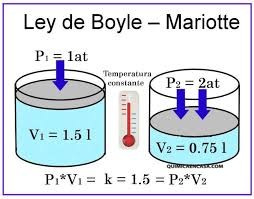
Su expresión matemática es: P.V = K y por lo tanto:
P1.V1 = P2.V2
Las unidades que se utilizan en la práctica para medir la presión son: 1 atmósfera (atm) = 76cm de Hg = 760 mmHg.
Por ejemplo:
- Cierta masa de un gas ocupa, a temperatura constante, un volumen de 200 ml, a la presión de 680 mmHg. ¿Qué volumen ocupará ese gas a la presión de 1 atmósfera?
Datos:
V1 = 200 ml
P1= 680 mmHg
P2 = 1 atm = 760 mmHg
V2 = ?
V1/V2 = P2/P1 ⇒ P1.V1 = P2.V2
V2 = P1.V1 / P2
V2 = (680 mmHg x 200 ml) ÷ 760 mmHg
V2 = 136000 ÷ 760
V2 = 178,95 ml

