¡Oh diamantes, diamantes! Todas las chicas amamos los diamantes; su belleza excepcional nos hace destacar y presumir elegancia. Tanto es así que para la célebre Marilyn Monroe “Los mejores amigos de las mujeres son los diamantes.” Pero dentro de tanta belleza y majestuosidad que ostentan los diamantes, hay una química interesante de la cual estoy segura que Marilyn desconocía; aunque quizás la esté subestimando. ¡Sorry señorita Monroe!

La palabra diamante deriva del antiguo griego adámas que significa invencible, esto debido a su increíble dureza, según la escala de Mohs, el diamante alcanza el rango más elevado por la resistencia que presenta a la rayadura, haciéndolo el material natural más duro del mundo.

Ahora bien, químicamente hablando el diamante es un alótropo del carbono donde los átomos de dicho elemento están situados en una red cristalina cúbica centrada en la cara, denominada red de diamante. Entonces, cada átomo de carbono está conectado a enlaces covalentes a otros cuatro átomos de carbono, dispuestos en un tetraedro. Dichos tetraedros, forman la red tridimensional de la que hable anteriormente, formada por anillos de carbono de seis piezas, parecido al ciclo hexano, en una conformación del tipo silla, generando tensión de ángulo de enlace de cero. Esta red estable de enlaces covalentes y anillos hexagonales es la razón por la cual el diamante es el mineral más duro, hasta ahora.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí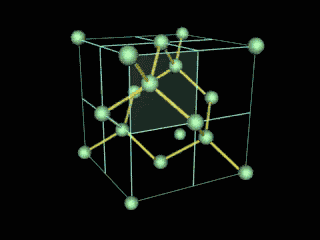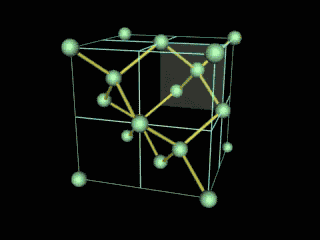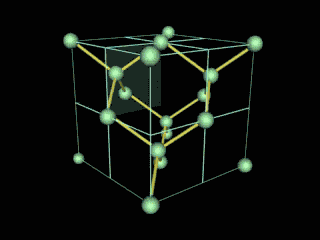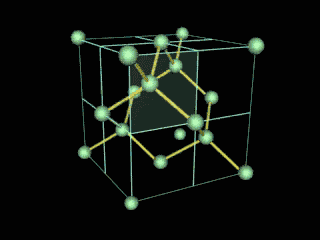
La alotropía es la propiedad de algunas sustancias simples de poseer estructuras atómicas o moleculares diferentes.
Pero ¿cómo se forma un diamante?
Los diamantes se forman a través del carbón a condiciones extremas de presión y temperatura. Dicho proceso es muy complicado y puede llegar a tardar hasta billones de años. El proceso se lleva a cabo en la capa litosférica, que se sitúa entre 150 a 200 kilómetros bajo la superficie y en donde se facilitan las condiciones extremas. La temperatura puede alcanzar entre 900 °C y 1300 °C y un nivel de presión de 30 kilobars. En este instante, el carbón adopta una forma molecular cúbica y se mineraliza transformándose en un diamante.

Diamantes coloreados
Los diamantes al presentar una estructura cristalina considerablemente rígida de apariencia transparente e incolora, pueden ser contaminados por escasos tipos de impurezas, como el nitrógeno y el boro. Tan solo pequeñas cantidades de estos elementos, generan una coloración que hace lucir los diamantes de forma más interesante. El boro produce una coloración azul en los diamantes, por otra parte el color amarillo es producto de las impurezas de nitrógeno, y colores como marrón, verde, violeta, rosado, negro, naranja o rojo se deben a defectos cristalinos.
¿El diamante brilla o dispersa la luz?
En mineralogía, la capacidad que presenta los minerales para reflejar la luz, se le denomina brillo o lustre.
El diamante posee la capacidad de dispersar la luz de diferentes colores debido a que presenta un índice de refracción bastante alto, permitiendo de esta manera que la luz viaje más lentamente que cuando pasa a través de otras sustancias transparentes como el aire o el vidrio; ocasionando que la luz blanca se separe mejor en los colores del arcoíris, concediéndole una apariencia destellante.
Entonces ambos términos son correctos para elogiar la capacidad de los diamantes de no pasar desapercibidos, y Rihanna lo sabe muy bien.


