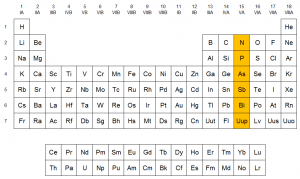
El grupo 15 de la tabla periódica es también llamado como la familia del nitrógeno o los nitrogenoideos.

El grupo 15 está formado por los siguientes elementos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el elemento sintético moscovium (Mc). Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míPropiedades físicas
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.

Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
El arsénico gris metálico: es la forma más estable de las tres y es un buen conductor del calor pero bastante malo conductor de electricidad.
El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
El arsénico negro: Presenta propiedades intermedias entre las formas anteriores.
De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
Antimonio puro gris plateado
Antimonio blanco azulado: es su forma más estable y metálica
Antimonio negro: Inestable y no metálico
Antimonio amarillo: Inestable y no metálico
El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
Propiedades químicas
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
Usos y aplicaciones de los elementos del grupo 15
Nitrógeno
El nitrógeno es un gas diatónico que presenta una gran cantidad de aplicaciones industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.

El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
Entre otros usos del gas nitrógeno tenemos:
- En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
- En la elaboración de acero inoxidable.
- Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves.
- Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza.
- En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo.
- En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico.
Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos. Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados.

En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.

De igual manera es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
Fósforo
Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
El fósforo rojo se emplea en la fabricación de cerillos, fósforos de seguridad, cohetes y en la elaboración de acero.

En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
El tributilfosfato se emplea el proceso purex para extraer uranio.
El fosfato de calcio es usado para elaborar porcelana fina.
El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.

Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
Arsénico
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.

Otro tipo de aleación es mezclado en pequeñas cantidades con el alfa latón para que sea más duro y resistente a la lixiviación de zinc. El alfa latón se emplea para elaborar piezas de tuberías u otros artículos que están en contacto constante con el agua.
Este metaloide es ampliamente usado en la fabricación de pesticidas, herbicidas e insecticidas, aunque actualmente se ha estado prohibiendo por su alta toxicidad.

Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos.

En medicina fue usado en el tratamiento de algunas enfermedades como la sífilis, mucho antes del descubrimiento de la penicilina.
Actualmente es utilizado como aditivo en pequeñas cantidades en los alimentos de animales para prevenir enfermedades y ayudar a su desarrollo.
También se emplea en el tratamiento de un tipo de cáncer llamado leucemia promielocítica aguda.
Así mismo es empleado en la preparación de soluciones médicas de Fowler para el tratamiento de la psoriasis.
Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
Antimonio
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.

También es usado en aleaciones con otros elementos como por ejemplo, con estaño para obtener un metal antifricción; igualmente en el peltre, metal inglés, entre otros. De igual manera, se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza. Esta misma aleación es utilizada para elaborar piezas de imprenta.

Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
- El trifluoruro de antimonio se utiliza para la fluoración
- El pentacloruro de antimonio se emplea en la cloración
- El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
- El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
- El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
- El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
- El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos.
- La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica.
Bismuto
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.
Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.

Los compuestos de bismuto poseen una variedad de usos en cosméticos, por ejemplo el oxicloruro de bismuto, usualmente es empleado como pigmento en sombras de ojos, espray para el cabello y esmalte para uñas.

En el campo de la medicina es utilizado en la elaboración de varios medicamentos para el tratamiento de gripes, alergias y diarreas. El subsalicilato de bismuto es empleado para tratar la diarrea, acidez estomacal y malestar estomacal.

Moscovium
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades y conocerse muy poco sobre ellos, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.


