El equilibrio químico es el estado de un sistema donde no se observan cambios en la concentración de los reactivos o productos, y que al transcurrir el tiempo, estas se mantienen constantes.

Este proceso se da en las reacciones reversibles, donde la velocidad de las reacción de reactivos a productos es la misma que de productos a reactivos.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de míConstante de equilibrio químico
La constante Kc para una reacción en equilibrio, es una fracción cuyo numerador es el producto de las concentraciones en mol/L de las sustancias del lado derecho y el denominador es el producto de las concentraciones en mol/L del lado izquierdo, cada concentración elevada a una potencia igual al coeficiente de la respectiva sustancia en la ecuación química balanceada.
La expresión matemática para Kc sería la siguiente:
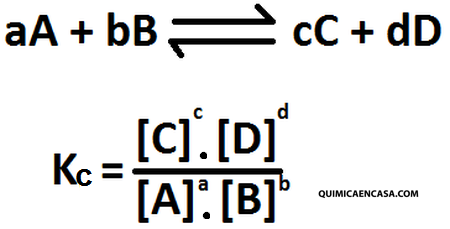
Todas las especies químicas deben estar en estado gaseoso para participar en el equilibrio. En el caso de que alguno de los productos o reactantes estén en estado sólido o líquido, no se les considera en la expresión de equilibrio (Kc) debido a la poca variación que sufren durante el proceso.
Por ejemplo, se tiene la siguiente reacción:
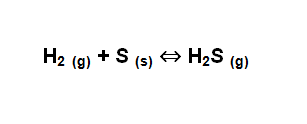
El primer paso es observar si necesita ser balanceada y luego descartar las especies que estén en estado sólido o en estado líquido.
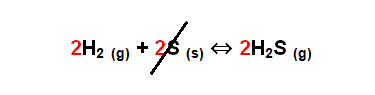
Para finalmente, escribir la expresión de la constante de equilibrio químico:
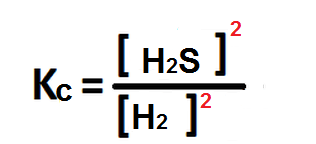
Ahora bien, se puede hallar el valor de Kc sabiendo que las especies involucradas presentan las siguientes concentraciones:
H2S = 5 mol/L
H2 = 1,5 mol/L
Sustituyendo en la constante anterior, nos queda:
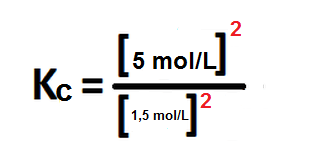
Kc= 11,11
- En un recipiente de 1 litro de capacidad se encuentran mezclados 10 moles de CO y 5 moles de H2O, sabiendo que la Kc es 8,25. Calcule la concentración en equilibrio de todas las especies involucradas en la reacción.
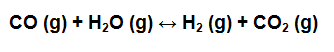
Primero se balancea la reacción si es necesario y luego se escribe la expresión de Kc para la reacción:
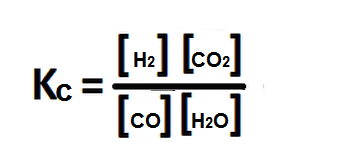
Luego se hallan las concentraciones en el equilibrio.
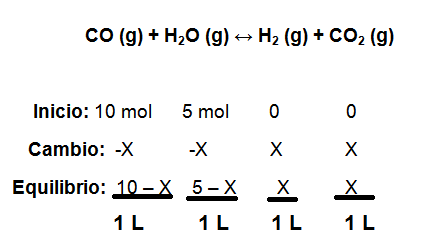
Ahora sustituimos los valores de las concentraciones en equilibrio en la constante de equilibrio anterior:
Se descarta el valor del volumen ya que para efecto de los cálculos matemáticos, es despreciable.

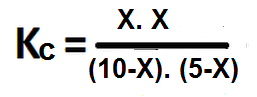
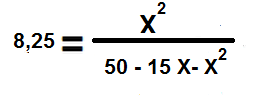
8,25. (50-15X +X2 ) = X2
412,5 – 123,75 X + 8,25 X2 – X2 = 0
412, 5 – 123,75 X + 7,25 X2 = 0
Se aplica la ecuación de segundo grado:
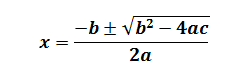
y queda que X1 = 12,53 y X2= 4,54. El valor que tomaremos para hallar las concentraciones en equilibrio es el de X2 ya que el valor de X1 es muy alto con respecto a las concentraciones iniciales.
Finalmente se hallan las concentraciones en el equilibrio:
H2 = CO2 = X = 4,54 mol ÷ 1 Litro = 4,54 mol/L
CO = 10 – X = 10- 4,54 ÷ 1 Litro = 5,46 mol/L
H2O = 5- X = 5- 4,54 ÷ 1 Litro = 0,46 mol/L

