
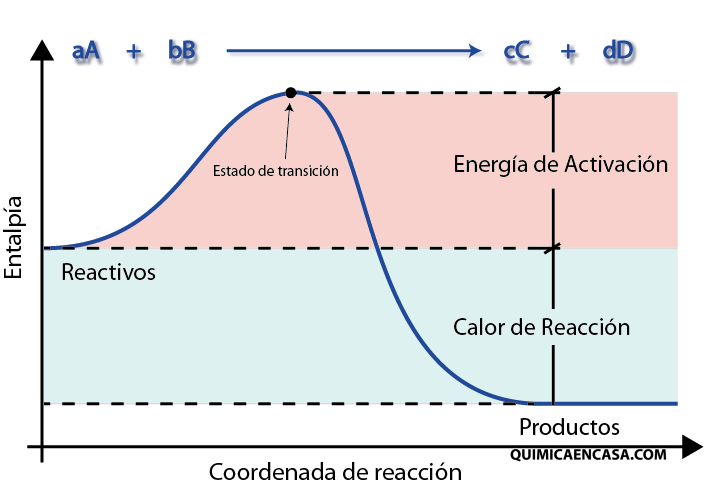
La cantidad de energía adicional que hace falta para que un choque sea efectivo es lo que se conoce como Energía de Activación.
Esta porción de energía es comparable con la chispa que inicia el proceso. Muchos sistemas químicos, a pesar de su nivel energético alto, se mantienen indiferentes al cambio químico, como es el caso de la pólvora dentro de un cartucho, la gasolina expuesta al oxígeno del aire; es necesario introducir al sistema una cierta energía de activación.
Una vez comenzado el proceso, este se realiza en forma continua, debido a que el calor generado por la transformación de las primeras moléculas, suministran la energía para la transformación de las que siguen y estas, con su transformación, liberan la energía necesaria para que otras reaccionen, y así sucesivamente.
¡Haz amigos nuevos GRATIS! 🌍
¿Cansado de la rutina? Únete a la mejor plataforma gratuita para conocer gente y compartir tus aficiones en tu ciudad.
Descubrir planes cerca de mí¿Cómo se producen las reacciones químicas?
Como se explicó anteriormente, la energía de activación es la cantidad mínima de energía necesaria para la ruptura o formación de un enlace químico, y es especifico según sea cada proceso.
En los choques efectivos se forma una estructura intermedia entre reaccionantes y productos, en la que se encuentran involucrados todos los materiales y que se denomina Complejo Activado o Estado de Transición. Su formación es la que determina la velocidad del proceso.
Es necesario aclarar que el Estado de Transición no es una sustancia que se puede aislar o preparar experimentalmente, sino más bien es una estructura intermedia entre el material inicial y el que se logra al final del proceso.
Molecularidad de una reacción
Es el número de moléculas involucradas en la formación de este complejo durante el proceso químico. Si lo hace una sola molécula el proceso se denominará “unimolecular”, si son más moléculas se utilizarán los prefijos griegos “bi”, “tri”, y así sucesivamente.
Choques efectivos
Un proceso instantáneo se explica con un elevado porcentaje de choques efectivos, como es el caso de los análisis químicos cualitativos, entre ellos el reconocimiento del ion plata (Ag+), a través de la formación de un precipitado, es decir un sólido insoluble.
Ejemplo:
Ag+ + Cl– → AgCl
Las sustancias se encuentran disueltas en el agua, permitiendo un grado de dispersión que favorece el movimiento de las partículas. Esto facilita los choques efectivos.

